COMERCIALIZACIÓN ILEGAL Y FALSIFICACIÓN DEL PRODUCTO SEVOGESIC (SEVOFLURANO 100%)
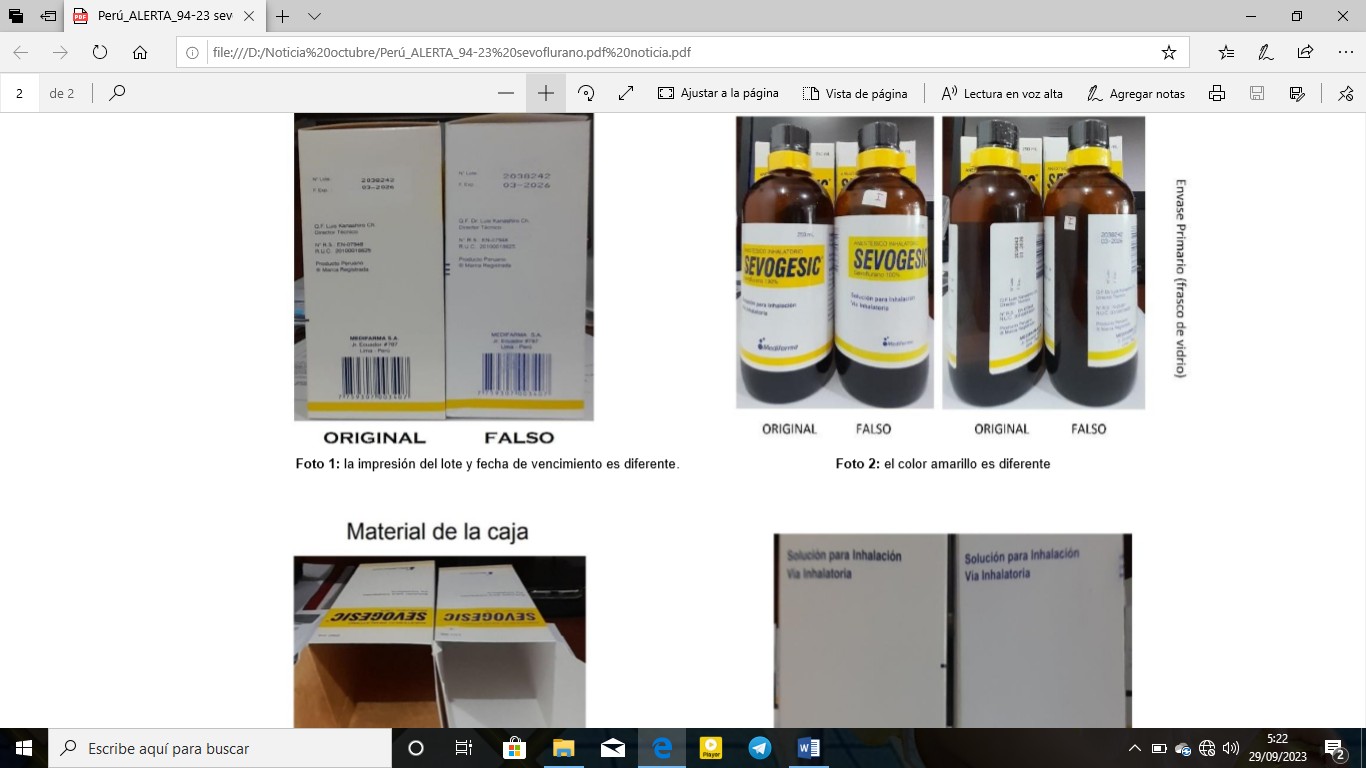
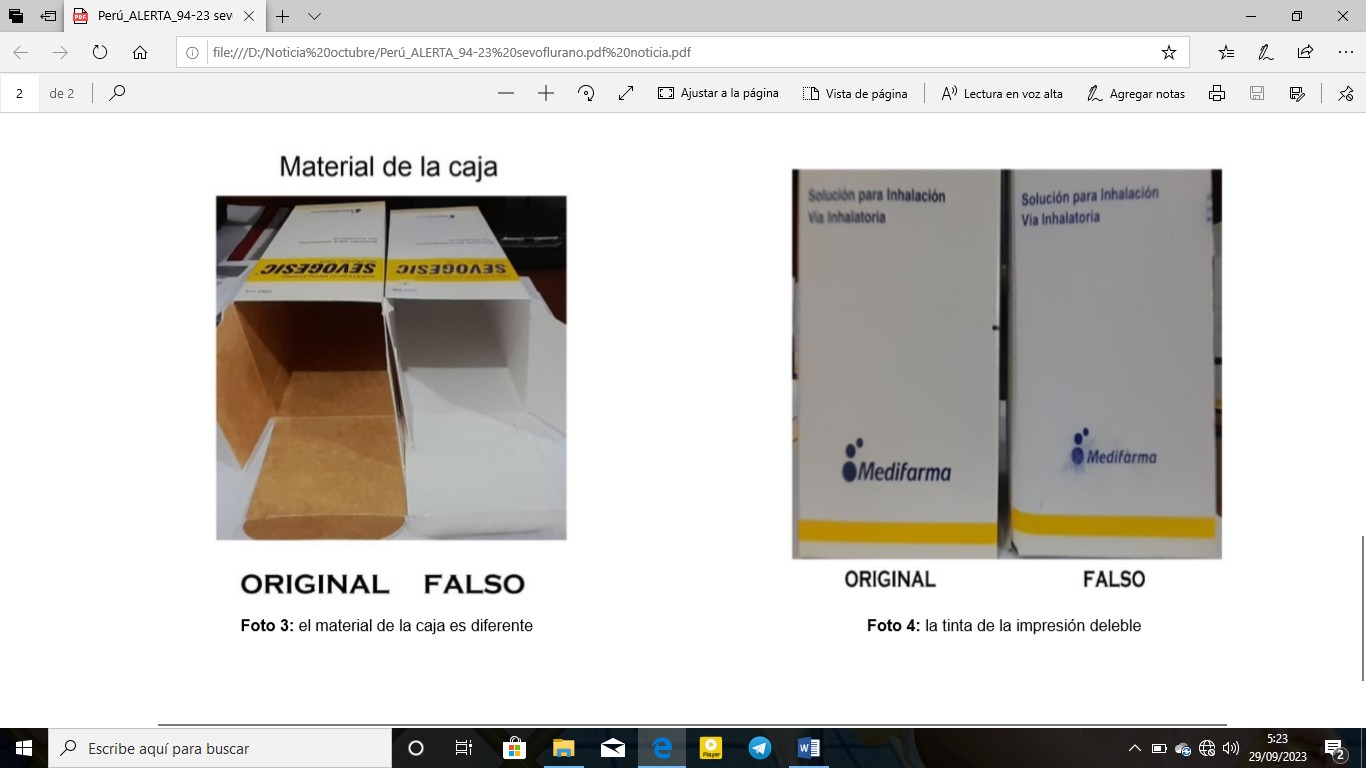
La Dirección General de Medicamentos, Insumos y Drogas (Digemid) del Ministerio de Salud de Perú, ha emitido una alerta a la población, sobre la falsificación del producto SEVOGESIC (SEVOFLURANO 100 %) Solución para inhalación, frasco x 250mL con el número de lote identificado 2038242.
La alerta se emite derivado del análisis y evaluación de la información remitida por las acciones de control y vigilancia sanitaria de productos farmacéuticos, dispositivos médicos y productos sanitarios, en la que a nivel nacional, se ha identificado un establecimiento farmacéutico donde se comercializaba el siguiente producto SEVOGESIC (SEVOFLURANO 100 %) falsificado
Teniendo en cuenta que viajeros internacionales pueden adquirir el producto,el CECMED recomienda:
-
A la población no adquirir el producto SEVOGESIC (SEVOFLURANO 100 %) Solución para inhalación, frasco x 250mL 2038242. ya que se desconoce el origen, las condiciones de fabricación y de almacenamiento. Adquirir productos con proveedores autorizados y validados por la Empresa Titular del Registro Sanitario. No adquirirlo si es de procedencia ilegítima ya que puede estar comprometida su calidad, seguridad y eficacia.
-
A los profesionales de la salud: en caso de identificar este producto o detectar sospechas de reacciones adversas asociadas a su uso, notificar al correo: vigilancia@cecmed.cu o a los teléfonos 72164372, 72164352, 72164136.
Disponible en:
https://www.digemid.minsa.gob.pe/webDigemid/alertas-modificaciones/2023…
La Habana, 09 de octubre de 2023.
Tags
COMUNICACIÓN DE RIESGO No. 24/2023. CLODIAZEPOXIDO 10 MG, TABLETAS, FALSIFICADO
El Servicio de Información sobre Medicamentos del CECMED, en los últimos meses ha recibido varias notificaciones sobre la sospecha de falsificación del producto Clodiazepoxido 10 mg, atribuido a Boehringer-Ingelheim (Figura No. 1). En todos los casos este producto ha sido obtenido en el mercado informal.
Luego de analizadas las evidencias fotográficas, se pudo verificar que:
En la etiqueta del producto se observan elementos (errores ortográficos; mezcla de idiomas; código de barras no genuino, calidad de la etiqueta) que permiten concluir Clodiazepoxido 10 mg no es un producto genuino.
Refieren que contiene bromhexine, principio activo broncodilatdor, que no se corresponde con la indicación del Clordiazepóxido
Boehringer-Ingelheim anteriormente ha declarado que no es titular de registro de Clordiazepóxido 10 mg, ni en Cuba ni en ningún otro país donde tienen titularidad, pues este no se encuentra entre los medicamentos que produce.
El CECMED ha emitido anteriormente una comunicación de riesgo (No. 01/2021[1]) para un producto con elementos muy similares a este (solo se diferencia en el color de la etiqueta y en el nombre del producto), el cual fue clasificado como medicamento falsificado
La Organización Mundial de la Salud (OMS) define como PRODUCTO MÉDICO FALSIFICADO[2] aquel que tergiversa de forma deliberada/fraudulenta su identidad, composición o fuente.
Teniendo en cuenta el análisis de la evidencia fotográfica, los antecedentes y la definición de la OMS, se puede determinar que el producto notificado como Clodiazepoxido 10 mg, atribuido a Boeringher Ingelheim es un MEDICAMENTO FALSIFICADO, por lo cual no se puede garantizar su calidad, seguridad y eficacia; constituye un riesgo inaceptable para la salud de la población; por lo que NO SE RECOMIENDA SU USO.
EL CECMED SOLICITA QUE ANTE LA DETECCIÓN DE ESTE PRODUCTO U OTROS SOSPECHOSOS DE FALSIFICACION, O LA APARICIÓN DE EVENTOS ADVERSOS RELACIONADOS A ESTOS SE NOTIFIQUE AL CORREO: vigilancia@cecmed.cu o a los teléfonos 72164372, 72164352, 72164136 o vía wassap 52136643
La Habana, Cuba. 2 de octubre de 2023
Tags
COMUNICACIÓN DE RIESGO No. 23/2023. DEFITELIO (DEFIBROTIDA) FALSIFICADO IDENTIFICADO EN LAS REGIONES DE EUROPA Y SUDESTE ASIÁTICO DE LA OMS
La Organización Mundial de la Salud (OMS )ha emitido la alerta de producto médico N°7/2023, referida a un lote falsificado de DEFITELIO (defibrotida sódica). Este producto falsificado ha sido detectado en India (abril de 2023) y Türkiye (julio de 2023) y se suministró fuera de los canales regulados y autorizadosLa OMS ha emitido anteriormente alertas sobre DEFITELIO falsificado detectado en otros países y regiones (Alerta de Productos Médicos N°5/2020 y N°3/2023).
La Organización Mundial de la Salud (OMS )ha emitido la alerta de producto médico N°7/2023, referida a un lote falsificado de DEFITELIO (defibrotida sódica). Este producto falsificado ha sido detectado en India (abril de 2023) y Türkiye (julio de 2023) y se suministró fuera de los canales regulados y autorizadosLa OMS ha emitido anteriormente alertas sobre DEFITELIO falsificado detectado en otros países y regiones (Alerta de Productos Médicos N°5/2020 y N°3/2023).
DEFITELIO (defibrotida) está indicado para el tratamiento de la enfermedad venooclusiva hepática (EVO), también conocida como síndrome obstructivo sinusoidal (SOS), en la terapia de trasplante de células madre hematopoyéticas (TCMH). Está indicado para adultos, adolescentes, niños y lactantes mayores de un mes. La EVO es una afección en la que las venas del hígado se bloquean e impiden que el hígado funcione correctamente.
El fabricante legitimo de DEFITELIO ha confirmado que el producto al que se refiere esta Alerta es falsificado. El fabricante original ha aconsejado que:
-
El DEFITELIO genuino con el lote 20G20A se empaquetó en embalaje alemán/austriaco.
-
En cambio, los productos falsificados se encuentran en envases del Reino Unido/Irlanda.
-
La fecha de caducidad indicada es falsa y no cumple con la vida útil registrada.
-
El número de serie indicado no está asociado con el lote 20G20A.
-
DEFITELIO no tiene autorización de comercialización en India y Türkiye.
El uso de DEFITELIO falsificado dará como resultado un tratamiento ineficaz de los pacientes y puede plantear otros riesgos graves para la salud, debido a su administración intravenosa y podría poner en peligro la vida en algunas circunstancias.
Actualmente, la OMS no tiene conocimiento de ningún informe de eventos adversos tras el uso de este DEFITELIO falsificado; sin embargo, se desconoce la seguridad, esterilidad y calidad de los productos falsificados a los que se hace referencia en esta alerta, por lo que la OMS recomienda que no se utilice.
Teniendo en cuenta que viajeros internacionales pueden adquirir el producto, el CECMED recomienda:
- A la población no adquirir el lote señalado del producto DEFITELIO, medicamento del cual no se puede garantizar su calidad, seguridad y eficacia.
-
A los profesionales de la salud: en caso de identificar este producto o detectar sospechas de reacciones adversas asociada a su uso, notificar al correo: vigilancia@cecmed.cu o a los teléfonos 72164372, 72164352, 72164136.
La Habana, Cuba, 11 de septiembre de 2023
Tags
COMUNICACIÓN DE RIESGO No. 22/2023. COLD OUT (PARACETAMOL Y MALEATO DE CLORFENAMINA) DE CALIDAD SUBESTÁNDAR
La Organización Mundial de la Salud (OMS) ha emitido su alerta No. 06/2023 referida al lote SF001A02 de jarabe COLD OUT (paracetamol y maleato de clorfenamina) de calidad subestándar (contaminado con dietilenglicol y etilenglicol) detectado en la República del Irak, que una tercera parte notificó a la OMS el 10 de julio de 2023.
Los jarabes que contienen paracetamol y clorfenamina se utilizan para tratar y aliviar los síntomas del resfriado común y los procesos alérgicos.
El consumo de dietilenglicol o de etilenglicol es tóxico para el ser humano y puede causar la muerte. El lote de calidad subestándar objeto de la presente alerta no es seguro y su administración, sobre todo a los niños, puede causar lesiones graves y la muerte. Los efectos tóxicos pueden ir desde dolores abdominales, vómitos, diarrea, incapacidad para orinar, cefalea y alteración del estado mental hasta lesiones renales agudas potencialmente mortales.
En un análisis realizado en un laboratorio de una muestra del jarabe COLD OUT tomada en Irak se detectó contaminación por dietilenglicol (0,25 %) y etilenglicol (2,1 %) en cantidades inaceptables. Los porcentajes máximos aceptables de ambas sustancias por motivos de seguridad son del 0,10 %.
En el envase del lote afectado se indica que el fabricante es FOURRTS (INDIA) LABORATORIES PVT. LTD y que el producto se fabrica para la empresa DABILIFE PHARMA PVT. LTD. (INDIA). Por el momento, ni el fabricante declarado ni el distribuidor han ofrecido garantía alguna a la OMS de la calidad y la inocuidad del producto.
La OMS ha publicado anteriormente otras cinco alertas relativas a productos médicos en formulación líquida contaminados, con las referencias n. º 6/2022, n. º 7/2022, n. º 1/2023, nº 4/2023 y n. º 5/2023.
Es posible que el producto objeto de la presente alerta tenga licencia de comercialización en otros países o regiones, o que se haya distribuido en otros países a través de mercados no oficiales.
Teniendo en cuenta que viajeros internacionales pueden adquirir el producto, el CECMED recomienda:
- A la población no adquirir ni utilizar el lote señalado del producto COLD OUT, el cual tiene cantidades no aceptables de dietilenglicol y etilenglicol, los cuales resultan dañinos al organismo.
- A los profesionales de la salud: en caso de identificar este producto o detectar sospechas de reacciones adversas asociada a su uso, notificar al correo: vigilancia@cecmed.cu o a los teléfonos 72164372, 72164352, 72164136.
La Habana, Cuba, 16 de agosto de 2023
COMUNICACIÓN DE RIESGO No. 21/2023. NATURCOLD CONTAMINADO CON DIETILENGLICOL
La Organización Mundial de la Salud (OMS) ha emitido su Alerta No. 5/2023, referida al lote E22053, de jarabe NATURCOLD, de calidad subestándar (contaminado con dietilenglicol). Este producto fue identificado en Camerún y notificado por primera vez a la OMS el 13 de marzo de 2023.
El comercializador declarado del producto afectado figura en el empaque del producto como FRAKEN INTERNATIONAL (Inglaterra). La Autoridad Reguladora Nacional del Reino Unido, la MHRA, ha confirmado que no existe tal fabricante en este pais. Todavía se están realizando investigaciones para determinar el origen del producto. Por lo tanto, el fabricante mencionado no ha proporcionado garantías a la OMS sobre la seguridad y calidad de estos productos.
Las muestras del jarabe NATURCOLD de Camerún se pusieron a disposición de la OMS el 27 de junio de 2023 y se analizaron en un laboratorio precalificado y contratado por la OMS. El análisis encontró que el producto contenía cantidades inaceptables de dietilenglicol como contaminante. Se detectó hasta un 28,6 % del contaminante y el límite aceptable es de 0,10 %.
El dietilenglicol y el etilenglicol son tóxicos para los humanos cuando se consumen y pueden resultar fatales. El producto contaminado al que se hace referencia en esta alerta no es seguro y su uso, especialmente en niños, puede provocar lesiones graves o la muerte. Los efectos tóxicos pueden incluir dolor abdominal, vómitos, diarrea, incapacidad para orinar, dolor de cabeza, estado mental alterado y lesión renal aguda que puede conducir a la muerte.
Durante el 2023 se han registrado tres incidentes en los que se identificó jarabes contaminados, con dietilenglicol y el etilenglicol, en los países: Uzbekistán y Camboya (Enero , alerta N°1/2023); Islas Marshall y Micronesia (Abril, alerta N°4/2023), Camerún (Julio, alerta N°5/2023). La OMS ha realizado un llamado urgente para prevenir, detectar y responder a incidentes de productos médicos falsificados y de calidad subestándar
Teniendo en cuenta que viajeros internacionales pueden adquirir el producto, el CECMED recomienda:
- A la población no adquirir el lote señalado del producto NATURCOLD el cual tiene cantidades no aceptables de dietilenglicol y resulta dañino al organismo.
- A los profesionales de la salud: en caso de identificar este producto o detectar sospechas de reacciones adversas asociada a su uso, notificar al correo: vigilancia@cecmed.cu o a los teléfonos 72164372, 72164352, 72164136.
La Habana, Cuba, 16 de agosto de 2023
SOBRE LA COMERCIALIZACIÓN ILEGAL DEL PRODUCTO TIAMI-NAL 50MIL, SOLUCIÓN INYECTABLE
La Comisión Federal para la Protección Contra Riesgos Sanitarios (Cofepris), Autoridad Reguladora de México, ha emitido una alerta a la población, a partir del análisis y evaluación de la información remitida por los Laboratorios Vida+Nutrición, S.A. de C.V., quién indica que no cuentan, con Registro Sanitario ni Licencia para la fabricación de medicamentos. Entre los productos fabricados y/o comercializados por esta empresa, se encuentra Tiami-nal 50mil, solución inyectable, con 5 jeringas; el cual está indicado como suplemento vitamínico y señala contener Cianocobalamina (vitamina B12), tiamina (vitamina B1), Piridoxina (vitamina B6).
Teniendo en cuenta que viajeros internacionales pueden adquirir el producto, el CECMED recomienda:
-
A la población no adquirir el producto Tiami-nal 50mil, solución inyectable, con 5 jeringas ya que no cuenta con registro sanitario, ni con estudios que garanticen su calidad y eficacia de uso para medicamentos, por lo que representan un riesgo para la salud del consumidor.
-
A los profesionales de la salud: en caso de identificar este producto o detectar sospechas de reacciones adversas asociada a su uso, notificar al correo: vigilancia@cecmed.cu o llamar a los teléfonos 72164372, 72164352, 72164136.
Disponible en:
http://coepris.slpsalud.gob.mx/index.php/294-alerta-cofepris-por-labora…
La Habana, 28 de junio de2023.
Tags
SOBRE LA COMERCIALIZACIÓN ILEGAL Y FALSIFICACIÓN DEL PRODUCTO RENEGY® (CARBOXIMALTOSA FÉRRICA) 500MG/10ML, AMPOLLETAS
La Comisión Federal para la Protección Contra Riesgos Sanitarios (Cofepris), Autoridad Reguladora de México, ha emitido una alerta a la población, sobre la falsificación del producto RENEGY® (carboximaltosa férrica) 500mg/10mL, caja con un frasco ámpula con 10mL, con números de lote identificados en empaque secundario 0435054EA, fecha de caducidad SEP 23 y en empaque primario lote 0458967, fecha de caducidad DIC 23.
La alerta se emite derivado del análisis y evaluación de la información remitida por la empresa TAKEDA MÉXICO, S.A DE C.V. El Titular del registro sanitario corroboró la falsificación de este producto tras la identificación de varias diferencias en los empaques secundario y primario, la no coincidencia de los números de lote con los de la empresa y que los resultados de los análisis de identificación no son consistentes con el fármaco original.
Teniendo en cuenta que viajeros internacionales pueden adquirir el producto, el CECMED recomienda:
-
A la población no adquirir el producto RENEGY® (carboximaltosa férrica) 500mg/10mL), con número de lote empaque secundario 0435054EA y fecha de caducidad SEP 23 y número de lote en empaque primario 0458967 y fecha de caducidad DIC 23.
-
A los profesionales de la salud: en caso de identificar este producto o detectar sospechas de reacciones adversas asociada a su uso, notificar al correo: vigilancia@cecmed.cu o a los teléfonos 72164372, 72164352, 72164136.
Disponible en:
https://www.gob.mx/cms/uploads/attachment/file/831715/AlertaSanitaria_falsificaci_n_Renegy_12062023.pdf
La Habana, 28 de junio de2023.
Tags
COMUNICACIÓN DE RIESGO No. 19/2023. NEUROBION FALSIFICADO
El 1 de junio de 2023 se recibe, en el Servicio de Información de Medicamentos del CECMED, una consulta para comprobar si el producto NEUROBION, era un medicamento genuino.
NEUROBIÓN® es una asociación de vitaminas hidrosolubles del complejo B: Tiamina (vitamina B1), Piridoxina (vitamina B6) y cianocobalamina (vitamina B12) para su administración por vía oral. Está indicado en adultos y pacientes mayores de 14 años en estados carenciales de las vitaminas de B1, B6 y B12.[1]
Luego de analizadas las evidencias fotográficas (Figuras 1 y 2), se pudo verificar que:
1. En la etiqueta, se indica el producto para fortalecer los huesos, al incrementar la absorción del calcio, lo cual no se corresponde con la composición ni la indicación del producto de marca NEUROBIÓN®, que es complejo vitaminio B.
2. El código de barras, número de identificación único a nivel internacional, que aparece en la etiqueta, no se encuentra registrado en la base de datos internacional.[2]
3. Al buscar el sitio web[3] recomendado en la etiqueta no se puede acceder.
La Organización Mundial de la Salud (OMS) define como PRODUCTO MÉDICO FALSIFICADO aquel que tergiversa de forma deliberada/fraudulenta su identidad, composición o fuente.[4]
Teniendo en cuenta el análisis de las evidencias fotográficas y la definición de la OMS, se puede determinar que el producto notificado como NEUROBION, atribuido a Nature Made, es un MEDICAMENTO FALSIFICADO. En este tipo de producto no se puede garantizar su calidad, seguridad y eficacia; constituye un riesgo inaceptable para la salud de la población; por lo que NO SE RECOMIENDA SU USO.
EL CECMED SOLICITA QUE ANTE LA DETECCIÓN DE ESTE PRODUCTO U OTROS SOSPECHOSOS DE FALSIFICACION, O LA APARICIÓN DE EVENTOS ADVERSOS RELACIONADOS A ESTOS SE NOTIFIQUE AL CORREO: vigilancia@cecmed.cu o a los teléfonos 72164372, 72164352, 72164136.
La Habana, Cuba. 27 de junio de 2023
Tags
COMUNICACIÓN DE RIESGO No. 18/2023. KETOTIFENO FALSIFICADO
Durante el mes de junio de 2023, se han recibido en el Servicio de Información de Medicamentos del CECMED, dos notificaciones, de sospecha de falsificación del producto Ketotifeno, atribuido al fabricante STADA. Los productos sospechosos han sido obtenidos a través del mercado informal provenientes de Haití.
El ketotifeno se indica en la profilaxis a largo plazo del asma bronquial y de la bronquitis alérgica; como profilaxis y tratamiento de alergias multisistémicas, rinitis alérgica, conjuntivitis alérgica y reacciones cutáneas alérgicas.[1]
Luego de analizadas las evidencias fotográficas, de ambas notificaciones (figura 1 y figura 2), se pudo verificar que:
-
Ketotifeno STADA 1 mg, es un producto del Titular STADAPHARM, Alemania, que se presenta en cápsulas duras, no en tabletas.[2]
-
El NDC, es un número de identificación único para los medicamentos registrados en Estados Unidos, impreso en la etiqueta. En estos casos los números referidos en la presentación, no se encuentran en el Directorio NDC de este país.[3]
-
El código de barras, es un número de identificación internacional único para cada producto. En estos casos el número mostrado en las etiquetas no se encuentra en la base de datos internacional correspondiente.[4]
En la figura 1 se identifican otras incongruencias tales como:
-
Plavíx, es un producto del Titular Sanofi Aventis, de Francia, cuyo principio activo es clopidrogel, el cual se administra en adultos para prevenir la formación de coágulos sanguíneos (trombos) en vasos sanguíneos (arterias) endurecidos, un proceso conocido como aterotrombosis. Su principal efecto adverso es el sangramiento.[5]
-
Los datos troquelados en la tableta, FI 5, no se corresponden con el Ketotifeno, según el Identificador de tabletas Pill Identifier[6], sino con rosuvastatina cálcica, la cual es un medicamento indicado para tratar el colesterol alto y prevenir ataques cardíacos y accidentes cerebrovasculares.[7]
En la segunda notificación (figura 2)
-
Según el Identificador de tabletas Pill Identifier[8], los datos troquelados en la tableta, 5085 V, no se corresponden con el Ketotifeno, sino con Prednisona[9], la cual se indica en la supresión de manifestaciones clínicas inflamatorias y alérgicas de diferentes enfermedades.
La Organización Mundial de la Salud (OMS) define como PRODUCTO MÉDICO FALSIFICADO aquel que tergiversa de forma deliberada/fraudulenta su identidad, composición o fuente.[10]
Teniendo en cuenta el análisis de las evidencias fotográficas y la definición de la OMS, se puede determinar que los productos notificados como Ketotifeno, atribuido a STADA, son MEDICAMENTOS FALSIFICADOS, por lo cual no se puede garantizar su calidad, seguridad y eficacia. La utilización de estos productos constituye un riesgo inaceptable para la salud de la población; por lo que NO SE RECOMIENDA SU USO BAJO NINGUNA CIRCUNSTANCIA.
EL CECMED SOLICITA QUE ANTE LA DETECCIÓN DE ESTOS PRODUCTOS U OTROS SOSPECHOSOS DE FALSIFICACIÓN, O LA APARICIÓN DE EVENTOS ADVERSOS RELACIONADOS A ESTOS, SE NOTIFIQUE AL CORREO: vigilancia@cecmed.cu o llamar a los teléfonos 72164372, 72164352, 72164136
La Habana, Cuba. 28 de junio de 2023
Tags
JARABE CONTAMINADO DE GUAIFENESIN SYRUP TG SYRUP
La Dirección General de Medicamentos, Insumos y Drogas (DIGEMID) del Ministerio de Salud de Perú, emitió una alerta el 18 de mayo de 2023, después de ser verificada con la Organización Mundial de la Salud (OMS), sobre un lote del medicamento GUAIFENESIN SYRUP TG SYRUP frasco x 100Ml, lote SL-429 contaminado, vence 10/2023, del fabricante QP PHARMACHEM LTD, de Punjab (India) y su vendedor es TRILLIUM PHARMA, de Haryana (India). Este producto fue detectado en las Islas Marshall y los Estados Federados de Micronesia y notificados a la OMS el día 6 de abril de 2023.
La Guaifenesina es un expectorante que se emplea para aliviar la tos y la acumulación de flemas en los bronquios. En los análisis realizados en las muestras de GUAIFENESIN SYRUP TG SYRUP, por el Organismo de Productos Terapéuticos de Australia, se encontraron niveles no admisibles de los contaminantes dietilenglicol y etilenglicol. Hasta la fecha, ni el fabricante ni el vendedor han ofrecido garantías a la OMS de la seguridad y la calidad de estos productos.
El etilenglicol y el dietilenglicol son tóxicos para los humanos cuando se consumen y pueden resultar fatales. Su toxicidad está causada fundamentalmente por la acción de sus metabolitos; los cuales en el caso del etilenglicol son el glicolato y oxalato, responsables de la acidosis metabólica y el daño renal (cristales de oxalato cálcico); de forma similar el dietilenglicol es transformado en HEAA (ácido etoxihidroxi-acético), metabolito que es responsable del daño renal y neurológico[1].
La OMS ha publicado anteriormente tres alertas relativas a medicamentos en formulación líquida contaminados, que son las alertas N° 6/2022[2], N° 7/2022[3], N° 1/2023[4].
Los síntomas iniciales suelen ser digestivos y neurológicos (disminución del nivel de conciencia); puede producirse hipoglucemia en niños; se asocia posteriormente con acidosis metabólica muy intensa, insuficiencia renal (necrosis tubular y/o depósito de cristales de oxalato cálcico) y en algunos casos hipocalcemia, pancreatitis, hipotensión y shock; otras afectaciones neurológicas que pueden aparecer son neuropatía periférica y afectación de pares craneales (parálisis facial bilateral), encefalopatía, cuadriplejia, coma y muerte.
El CECMED no recomienda el uso de este producto, por el riesgo que representa para la salud la presencia de contaminantes. De encontrarse este medicamento en el territorio nacional, o que el consumo del mismo provoque una reacción adversa, debe ser notificado mediante el correo: vigilancia@cecmed.cu, o en el siguiente enlace https://ram.cecmed.cu/ o al Servicio de Información sobre Medicamentos en los teléfonos 72164136, 72164352, 72164372
Disponible:https://www.digemid.minsa.gob.pe/webDigemid/alertasmodificaciones/2023/alerta-digemid-no-41-2023/
La Habana, 15 de junio de 2023
[3] file:///S:/Vigilancia/UIVM/2023/B%C3%BAsqueda%20activa%20de%20informaci%C3%B3n/Noticias/Junio/Medical%20Product%20Alert%20N%C2%B07_2022%20Substandard%20(contaminated)%20paediatric%20liquid%20dosage%20medicines.htm
