ALERTA COFEPRIS SOBRE FALSIFICACION DE MEDICAMENTO HIPNOTICO
La Comisión Federal para la Protección contra Riesgos Sanitarios (Cofepris) el día 20 de Octubre de 2022, emitió una alerta sanitaria para prevenir riesgos a la salud de pacientes a causa del suministro del medicamento falsificado Zalixadol® (Midazolam), indicado como hipnótico.
Esta agencia reguladora informa a pacientes y profesionales de la salud, que es falso el lote 1708056 de Zadilaxol®, en formulación farmacéutica solución inyectable. En este producto se identifican los siguientes cambios, la nomenclatura 1708056, y la concentración 10mg/2mL, que no está autorizada, y el registro sanitario está escrito incorrectamente y la parte interna de la caja contiene un cartón doblado en forma de zigzag, además, las ampolletas falsas muestran dos franjas grises en la parte superior y los textos y su acomodo no corresponden con los autorizados para dicho producto.
Cofepris, recomienda a la población en caso de contar con este producto suspender su uso y contactar con el profesional de la salud y reportar cualquier reacción adversa o malestar causado tras el consumo de este medicamento.
De encontrarse este medicamento en el territorio nacional, a pesar de que en nuestro país no está registrado, debe ser notificado al CECMED, mediante el correo: vigilancia@cecmed.cu, o en el siguiente enlace https://ram.cecmed.cu/ o al Servicio de Información sobre Medicamentos en los teléfonos 72164136, 72164352, 72164372
Tags
COMUNICACIÓN DE RIESGO No. 13/2022: CLONAZEPAM FALSIFICADO
REPÚBLICA DE CUBA
MINISTERIO DE SALUD PÚBLICA
CENTRO PARA EL CONTROL ESTATAL
DE MEDICAMENTOS, EQUIPOS Y DISPOSITIVOS MÉDICOS
CECMED
COMUNICACIÓN DE RIESGO No. 13/2022
CLONAZEPAM FALSIFICADO
El 19 de octubre de 2022, se recibe vía correo electrónico una consulta, al Servicio de Información sobre Medicamentos de la Sección de Vigilancia del CECMED, de una ciudadana la cual requiere conocer si el producto Clonazepam, atribuido al fabricante Mylan®, es falsificado (figura 1). En dicha notificación no se precisa el país de procedencia del producto ni de la persona que realiza la consulta.
Figura 1. Evidencia fotográfica del producto sospechoso de falsificación
Luego de analizada la evidencia fotográfica, se pudo verificar que:
- En la imagen se visualiza el código NDC 0378-5512-67.
- El código nacional de medicamentos (NDC) es un identificador de producto único que se usa en los Estados Unidos, para medicamentos destinados al uso humano. El mismo contiene únicamente información sobre los medicamentos comercializados presentados electrónicamente a la FDA (Administración de Medicamentos y Alimentos, Estados Unidos) por los etiquetadores. La información del producto incluida en el directorio NDC no indica que la FDA haya verificado la información proporcionada por la etiqueta. Los números de NDC asignados no son de ninguna manera una indicación de la aprobación del producto por parte de la FDA.
- El número referido en la etiqueta del producto bajo investigación no se corresponde con ningún medicamento incluido en el Listado de Códigos NDC[1].
- El Clonazepam, tabletas, 2 mg no se encuentra actualmente dentro de la cartera de productos de Mylan® Pharmaceuticals[2],[3],[4].
- Según el directorio NDC este producto, estuvo incluido en el listado con el número 0378-1914-01, con una fecha de finalización de comercialización, el 30 de abril de 2020[5].
Figura 2 Evidencia fotográfica del producto sospechoso de falsificación. Advertencia para fenilcetonuria.
- En la imagen del frasco objeto de evaluación (figura 2), se advierte para las personas que padecen de fenilcetonuria, sobre el contenido de fenilalanina. Sin embargo, en la etiqueta empleada por el producto original (figura 3) durante su etapa de comercialización no se realizaba estaba advertencia.
Figura 3. Etiqueta del producto original durante su etapa de comercialización
La Organización Mundial de la Salud (OMS) define como PRODUCTO MÉDICO FALSIFICADO aquel que tergiversa de forma deliberada/fraudulenta su identidad, composición o fuente. [6]
Teniendo en cuenta el análisis de la evidencia fotográfica y la definición de la OMS, se puede determinar que el producto notificado como CLONAZEPAM es un MEDICAMENTO FALSIFICADO, por lo cual no se puede garantizar su calidad, seguridad y eficacia y constituye un riesgo inaceptable para la salud de la población.
EL CECMED SOLICITA QUE ANTE LA DETECCIÓN DE ESTE PRODUCTO U OTROS SOSPECHOSOS DE FALSIFICACION, O LA APARICIÓN DE EVENTOS ADVERSOS RELACIONADOS A ESTOS SE NOTIFIQUE AL CORREO: vigilancia@cecmed.cu
La Habana, Cuba, 1 de noviembre de 2022
Tags
COMUNICACIÓN DE RIESGO No. 11/2022 MEDICAMENTOS PEDIÁTRICOS DE CALIDAD SUBESTÁNDAR (CONTAMINADOS)
La Organización Mundial de la Salud (OMS), ha emitido su alerta No. 6 referida a cuatro medicamentos de calidad subestándar detectados en Gambia que les notificaron en septiembre de 2022. [1] Los productos médicos de calidad subestándar no cumplen las normas de calidad o las características técnicas establecidas.
Los cuatro productos son: Promethazine Oral Solution®, Kofexmalin Baby Cough Syrup®, Makoff Baby Cough Syrup® y Magrip N Cold Syrup®. La empresa Maiden Pharmaceuticals Limited (Haryana, India), que es el fabricante declarado de estos productos, no ha garantizado hasta la fecha a la OMS la seguridad y la calidad de estos productos.
Las pruebas analíticas realizadas con las muestras de cada uno de los cuatro productos confirman que contienen cantidades inaceptables de los contaminantes dietilenglicol y etilenglicol. Hasta la fecha, estos cuatro productos se han detectado en Gambia, pero es posible que se hayan distribuido a otros países o regiones a través de mercados informales.
Riesgos
El dietilenglicol y el etilenglicol son tóxicos para el ser humano y su consumo puede provocar la muerte.
Estos efectos tóxicos pueden ser: dolor abdominal, vómitos, diarrea, incapacidad para orinar, dolor de cabeza, alteración del nivel de conciencia y lesiones renales agudas que pueden provocar la muerte.
Se debe considerar que todos los lotes de estos productos son peligrosos hasta que las autoridades nacionales de reglamentación pertinentes los analicen.
Los productos de calidad subestándar a los que se hace referencia en esta alerta no son inocuos y su consumo, sobre todo por los niños, puede poner en peligro la vida.
LA OMS PIDE QUE SE AUMENTE LA VIGILANCIA Y LA DILIGENCIA EN LAS CADENAS DE SUMINISTRO DE LOS PAÍSES Y LAS REGIONES QUE PUDIERAN VERSE AFECTADOS POR ESTOS PRODUCTOS FALSIFICADOS.
EL CECMED SOLICITA QUE SI HA UTILIZADO ESTE PRODUCTO O SI PRESENTA ALGÚN EVENTO O REACCIÓN ADVERSA TRAS SU ADMINISTRACIÓN, CONSULTE DE INMEDIATO A UN PROFESIONAL DE LA SALUD CUALIFICADO Y NOTIFIQUE AL CORREO: vigilancia@cecmed.cu O AL SIGUIENTE ENLACE https://ram.cecmed.cu/
La Habana, Cuba, 7 de octubre de 2022
Tags
FALSIFICACIÓN DEL PRODUCTO KEYTRUDA® (PEMBROLIZUMAB)
El día 8 de septiembre la Comisión Federal para la Protección Contra Riesgos Sanitarios (COFEPRIS), de México, ha emitido una alerta sanitaria en seguimiento a una publicada el 9 de febrero de 2022, debido a que la empresa Merck Sharp and Dohme Comercializadora S. de R.L. de C.V., ha identificado nuevos lotes del producto KEYTRUDA® (pembrolizumab) falsificados.
Los números de lote que se han identificado hasta la presente como falsificados son: DC68976, DE68005, LT87333, NT78236, S012080, S032357, S035357, T009249, T021792, T032457, VZ01380, V011628 y W002260.
KEYTRUDA® (pembrolizumab) es un anticuerpo monoclonal, que se indica como monoterapia para el tratamiento del melanoma avanzado (irresecable o metastásico) en adultos, tratamiento de cáncer de pulmón no microcítico (CPNM) de histología escamosa, localmente avanzado o metastásico después de quimioterapia previa, en pacientes adultos.
En Cuba este medicamento no se encuentra registrado.
No obstante, teniendo en cuenta la posibilidad que viajeros internacionales comercialicen estos productos hacia Cuba, el CECMED recomienda:
• A la población que haya adquirido dichos productos, no consumirlos.
• A los profesionales de la salud, tener en cuenta, ante la utilización por parte de alguna persona, la ocurrencia de reacciones adversas.
• Notificar al CECMED, problemas relacionados con el medicamento, mediante el correo: vigilancia@cecmed.cu, o en el siguiente enlace https://ram.cecmed.cu/ o al Servicio de Información sobre Medicamentos en los teléfonos 72164136, 72164352, 72164372.
Tags
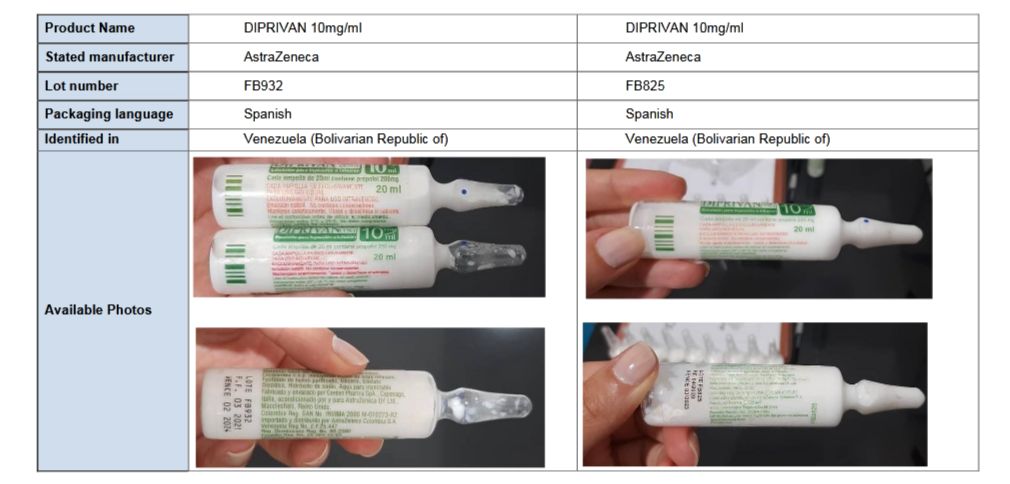
DIPRIVAN (PROPOFOL) FALSIFICADO, EN LA REGIÓN DE LAS AMÉRICAS. ALERTA DE LA OMS
La Organización Mundial de la Salud (OMS), ha emitido su alerta de producto médico No. 5/2022 referida a DIPRIVAN (propofol) falsificado, identificado en la República Bolivariana de Venezuela, en julio de 2022 y notificado a la OMS en agosto de 2022.
DIPRIVAN está indicado para su uso como anestésico general intravenoso, de acción corta, durante procedimientos quirúrgicos y de diagnóstico. Además, para la sedación de pacientes ventilados.
El producto original es fabricado por ASTRAZENECA para ASPEN. Ambos han confirmado que los productos a los que se hace referencia en esta alerta están falsificados sobre la base de que tergiversan de forma deliberada/fraudulenta su identidad y origen.
DIPRIVAN se fabrica para el mercado latinoamericano y está autorizado para uso local en varios países, incluidos Colombia, República Dominicana y Ecuador.
Los números de lote indicados (FB932 y FB825) están falsificados y nunca se han emitido para DIPRIVAN. También se han identificado errores de imprenta y ortografía y la línea de llenado es potencialmente inconsistente entre los viales identificados. Se desconoce la seguridad, esterilidad y calidad de los productos falsificados a los que se hace referencia en esta alerta. Por tanto, pueden suponer un riesgo especialmente alto para los pacientes.
Es importante detectar y retirar estos productos falsificados de la circulación para evitar daños a los pacientes.
La OMS solicita una mayor vigilancia y diligencia dentro de las cadenas de suministro de los países y regiones que probablemente se verán afectados por estos productos falsificados.
Tags
COMUNICACIÓN DE RIESGO No. 05/2022: El CECMED ALERTA SOBRE LAS CONSECUENCIAS DEL USO DE POTENCIADORES SEXUALES RHINO FALSIFICADOS
El Servicio de Información sobre Medicamentos del CECMED, recibió la notificación de un profesional de la salud, sobre un paciente del sexo masculino, de 53 años, de nacionalidad cubana, que consumió el producto Rhino, de fabricante desconocido, el cual se indica para prolongar la eyaculación. Los síntomas presentados fueron priapismo, vómitos, cefalea, dolor articular, hipertensión y decaimiento. El paciente requirió de atención médica y tratamiento en servicio de urgencia; luego de lo cual se recuperó. Se clasifica la reacción adversa como moderada, según su intensidad.
En una búsqueda de información sobre el producto Rhino, se detectó que:
• Desde el año 2007, la Administración de Alimentos y Medicamentos (FDA), Autoridad Reguladora de los Estados Unidos, ha advertido a la población en reiteradas ocasiones que: no compren, ni usen, los productos para aumentar la virilidad de la marca Rhino. En las alertas emitidas se informa, que: estos productos contienen ingredientes químicos ocultos y su empleo está asociado a un aumento del número de problemas de salud, tales como: dolor en el pecho, dolores de cabeza intensos y erecciones prolongadas, que han derivado en intervenciones quirúrgicas, así como hospitalizaciones debido a caídas drásticas en la presión arterial.[1],[2],[3],[4]
- La Agencia Nacional de Regulación, Control y Vigilancia Sanitaria (Arcsa), Autoridad Reguladora del Ecuador, también recomienda: no comercializar, distribuir, ni consumir estos productos ya que no posee registro sanitario ecuatoriano[5].
-
La FDA, informa que estos productos se comercializan en Estados Unidos como productos farmacéuticos para aumentar la virilidad y que con frecuencia son falsamente identificados como suplementos alimenticios, sin embargo contienen ingredientes activos ocultos y potencialmente dañinos¡Error! Marcador no definido..
En Cuba, estos productos no poseen registro sanitario ni forman parte del Cuadro Básico de Medicamento del país.
ESTA COMUNICACIÓN ALERTA DE LA POSIBLE PRESENCIA DE ESTE PRODUCTO EN LA REGIÓN Y EN EL PAÍS, POR LO CUAL RECOMENDAMOS LA ADOPCIÓN DE LAS MEDIDAS SANITARIAS DE SEGURIDAD CORRESPONDIENTES PARA EL CESE DE SU COMERCIALIZACIÓN. EL CECMED RECOMIENDA NO CONSUMIR LOS PRODUCTOS RHINO. SI LO HA UTILIZADO Y PRESENTA UNA REACCIÓN ADVERSA TRAS SU ADMINISTRACIÓN, CONSULTE DE INMEDIATO A UN PROFESIONAL DE LA SALUD CALIFICADO Y NOTIFIQUE AL CORREO: vigilancia@cecmed.cu
