FALSIFICACIÓN DEL PRODUCTO DOLO-NEUROBIÓN® FORTE DCS {COMPLEJO B (TIAMINA, PIRIDOXINA, CIANOCOBALAMINA) LIDOCAÍNA Y DICLOFENACO SÓDICO} SOLUCIÓN INYECTABLE.
La Comisión Federal para la Protección contra Riesgos Sanitarios (Cofepris) alerta a los profesionales de la salud y a la población sobre la falsificación y comercialización ilegal del producto Dolo-Neurobión® Forte DCS {Complejo B (tiamina, piridoxina, cianocobalamina) lidocaína y diclofenaco sódico} en presentación solución inyectable.
PROCTER & GAMBLE MANUFACTURING MÉXICO S. DE R. L. DE C.V., titular del registro sanitario, comunicó a esta autoridad sanitaria que el producto Dolo-Neurobión® Forte DCS se está comercializando ilegalmente en mercados y puestos ambulantes.
Los productos presentan irregularidades en los empaques primarios y secundarios, por lo que los lotes citados no son reconocidos como fabricados por la empresa.
El CECMED no tiene Registro Sanitario del producto Dolo-Neurobión® Forte DCS {Complejo B (tiamina, piridoxina, cianocobalamina) lidocaína y diclofenaco sódico} en presentación solución inyectable, del titular del registro sanitario PROCTER & GAMBLE MANUFACTURING MÉXICO S. DE R. L. DE C.V.; no obstante, teniendo en cuenta que viajeros internacionales pueden adquirirlo, recomienda:
• A la población no adquirir los lotes M33440, vence junio 25 y M93983, vence nov 27, del producto Eutirox® (levotiroxina sódica) tableta 100 mcg, ya que se desconoce el origen, las condiciones de fabricación y de almacenamiento y por tanto puede estar comprometida su calidad, seguridad y eficacia y constituyen un riesgo para la salud de la población.
• A los profesionales de la salud: en caso de identificar este producto o detectar sospechas de reacciones adversas asociadas a su uso, notificar al correo: vigilancia@cecmed.cu o a los teléfonos 72164372, 72164352, 72164136.
Disponible en: https://www.gob.mx/cms/uploads/attachment/file/920650/Alerta_sanitaria_Falsificaci_n_Dolo-neurobion_07062024.pdf
La Habana, 24 de julio de 2024
Tags
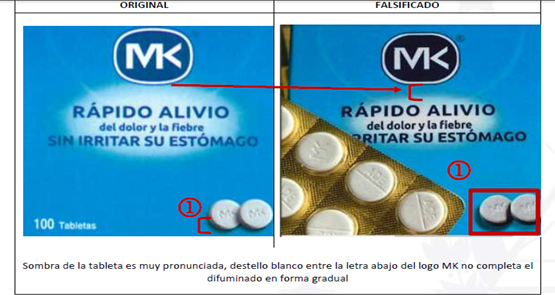
FALSIFICACIÓN Y COMERCIALIZACIÓN ILEGAL DEL PRODUCTO ACETAMINOFEN MK 500 MG TABLETA
La Dirección Nacional de Medicamentos de El Salvador, ha realizado una alerta a los profesionales de la salud y a la población sobre la falsificación y comercialización ilegal del producto ACETAMINOFEN MK 500 MG TABLETA, en presentación caja dispensadora x 10 blíster x 10 tabletas, con número de lote identificado L01961, con fecha de caducidad 12/27, afectando al número de registro 13275 (Figura No. 1).
 Este producto declara haber sido fabricado por CORPORACIÓN BONIMA, sin embargo, no tiene relación alguna con el producto original, por lo que la información que proporciona en su empaque es falsa y no cuenta con garantía alguna de calidad, ya que sus procesos de fabricación se encuentran fuera del marco legal y bajo condiciones irregulares.
Este producto declara haber sido fabricado por CORPORACIÓN BONIMA, sin embargo, no tiene relación alguna con el producto original, por lo que la información que proporciona en su empaque es falsa y no cuenta con garantía alguna de calidad, ya que sus procesos de fabricación se encuentran fuera del marco legal y bajo condiciones irregulares.
El CECMED no tiene Registro Sanitario del producto ACETAMINOFEN MK 500 MG TABLETA, no obstante, teniendo en cuenta que viajeros internacionales pueden adquirirlo, el CECMED recomienda:
-
A la población no adquirir el producto ACETAMINOFEN MK 500 MG TABLETA, lote identificado L01961, con fecha de caducidad 12/27, ya que se desconoce el origen, las condiciones de fabricación y de almacenamiento y por tanto puede estar comprometida su calidad, seguridad y eficacia.
-
A los profesionales de la salud: en caso de identificar este producto o detectar sospechas de reacciones adversas asociadas a su uso, notificar al correo: vigilancia@cecmed.cu o a los teléfonos 72164372, 72164352, 72164136.
Disponible en: https://www.redeami.net/alertas/documentos/070624221808.pdf
La Habana, 23 de julio de 2024
Tags
FALSIFICACIÓN Y COMERCIALIZACIÓN ILEGAL DEL PRODUCTO ERBITUX® (CETUXIMAB) 5MG/ML
La Comisión Federal para la Protección contra Riesgos Sanitarios (Cofepris), ha realizado una alerta a los profesionales de la salud y a la población sobre la falsificación y comercialización ilegal del producto ERBITUX® (Cetuximab) 5mg/ml en presentación caja con frasco ámpula, con número de lote identificado H88JQ2, con fecha de caducidad 12 2025, (Figura No. 1).
La alerta se emite por el análisis técnico y de la información presentada por la empresa Merck Biopharma Distribution S.A. de C.V., empresa autorizada por el fabricante Merck Healthcare KGaA para la importación y distribución del producto en México, identificó la distribución del producto, el cual no cuenta con registro sanitario, presenta textos en idioma inglés e inconsistencias en el etiquetado del empaque secundario.
El CECMED no tiene Registro Sanitario del producto ERBITUX® (Cetuximab) 5mg/ml, no obstante, teniendo en cuenta que viajeros internacionales pueden adquirirlo, el CECMED recomienda:
-
A la población no adquirir el producto ERBITUX® (Cetuximab) 5mg/ml, ya que se desconoce el origen, las condiciones de fabricación y de almacenamiento y por tanto puede estar comprometida su calidad, seguridad y eficacia.
-
A los profesionales de la salud: en caso de identificar este producto o detectar sospechas de reacciones adversas asociadas a su uso, notificar al correo: vigilancia@cecmed.cu o a los teléfonos 72164372, 72164352, 72164136.
Disponible en: https://www.gob.mx/cms/uploads/attachment/file/923063/Alerta_sanitaria_ERBITUX_21062024.pdf
La Habana, 24 de julio de 2024
Tags
FALSIFICACIÓN Y COMERCIALIZACIÓN ILEGAL DEL PRODUCTO DOBUTAMINA, SOLUCIÓN INYECTABLE INTRAVENOSA 250 MG/5 ML
 La Comisión Federal para la Protección contra Riesgos Sanitarios (Cofepris), ha realizado una alerta a los profesionales de la salud y a la población sobre la falsificación y comercialización ilegal del producto Dobutamina, Solución Inyectable Intravenosa 250 mg/5 mL, con cualquier número de lote, distribuido por BIOSISTEMAS Y SEGURIDAD PRIVADA, S.A. DE C.V. y fabricado por HEALTH BIOTECH LIMITED. El referido producto se encuentra relacionado con las notificaciones de al menos tres entidades federativas que señalan irregularidades.
La Comisión Federal para la Protección contra Riesgos Sanitarios (Cofepris), ha realizado una alerta a los profesionales de la salud y a la población sobre la falsificación y comercialización ilegal del producto Dobutamina, Solución Inyectable Intravenosa 250 mg/5 mL, con cualquier número de lote, distribuido por BIOSISTEMAS Y SEGURIDAD PRIVADA, S.A. DE C.V. y fabricado por HEALTH BIOTECH LIMITED. El referido producto se encuentra relacionado con las notificaciones de al menos tres entidades federativas que señalan irregularidades.
El CECMED no tiene Registro Sanitario del producto Dobutamina, Solución Inyectable Intravenosa 250 mg/5 mL, de HEALTH BIOTECH LIMITED, no obstante, teniendo en cuenta que viajeros internacionales pueden adquirirlo, el CECMED recomienda:
-
A la población no adquirir el producto Dobutamina, Solución Inyectable Intravenosa 250 mg/5 mL, de HEALTH BIOTECH LIMITED, ya que se desconoce el origen, las condiciones de fabricación y de almacenamiento y por tanto puede estar comprometida su calidad, seguridad y eficacia.
-
A los profesionales de la salud: en caso de identificar este producto o detectar sospechas de reacciones adversas asociadas a su uso, notificar al correo: vigilancia@cecmed.cu o a los teléfonos 72164372, 72164352, 72164136.
Disponible en: https://www.gob.mx/cms/uploads/attachment/file/923868/Alerta_sanitaria_de_Dobutamina_26062024.pdf
La Habana, 24 de julio de 2024
Tags
COMUNICACIÓN DE RIESGO No. 17/2024. Olanzapine Tablets USP, 10 mg, FALSIFICADO
El Servicio de Información sobre Medicamentos del CECMED, recibió una consulta, de un profesional de salud, para comprobar si el producto Olanzapine Tablets, 10 mg, atribuido a Prasco Laboratories era genuino. Este producto fue obtenido mediante el mercado informal y consumido por una paciente ocasionándole efectos adversos tales como náuseas y vómitos.
Tags
COMUNICACIÓN DE RIESGO No. 16/2024. Domperidona, 20 mg, FALSIFICADO
El Servicio de Información sobre Medicamentos del CECMED, recibió una consulta, de una profesional de salud, de la región central del país, para comprobar si el producto Domperidona, 20 mg, atribuida a Apotex INC era genuino.
Luego de analizadas las evidencias fotográficas, se pudo verificar que:
-
El código DIN 01940309 no existe, en la base de datos de Health Canada[1].
-
La etiqueta muestra una información que no se corresponde para este tipo de medicamentos como, por ejemplo: refiere que la Domperidona es un analgésico antiinfamatorio y la posología recomendada no es la empleada.
-
La información está en dos idiomas: inglés y francés.
-
Las condiciones de almacenamiento difieren entre lo descrito en cada idioma: inglés (15-20 °C) y francés (15-30 °).
La Organización Mundial de la Salud (OMS) define como PRODUCTO MÉDICO FALSIFICADO aquel que tergiversa de forma deliberada/fraudulenta su identidad, composición o fuente[2].
Teniendo en cuenta el análisis de la evidencia fotográfica y la definición de la OMS, se concluye que el producto Domperidona, 20 mg, es un MEDICAMENTO FALSIFICADO, por lo cual no se puede garantizar su calidad, seguridad y eficacia; constituye un riesgo inaceptable para la salud de la población; por lo que NO SE RECOMIENDA SU USO.
EL CECMED SOLICITA QUE ANTE LA DETECCIÓN DE ESTE PRODUCTO U OTROS SOSPECHOSOS DE FALSIFICACION, O LA APARICIÓN DE EVENTOS ADVERSOS RELACIONADOS A ESTOS SE NOTIFIQUE AL CORREO: vigilancia@cecmed.cu o a los teléfonos 72164372, 72164352, 72164136.
La Habana, Cuba. 8 de julio de 2024
Tags
COMUNICACIÓN DE RIESGO No. 15/2024. METHOCARBAMOL 750 mg FALSIFICADO
El Servicio de Información sobre Medicamentos del CECMED, recibió una consulta de una profesional de salud, de la región central del país, para comprobar si el producto METHOCARBAMOL, 750 mg era genuino.
El metocarbamol es un relajante muscular, de acción central, cuya acción podría ser debido a un efecto depresor general sobre el Sistema Nervioso Central. Bloquea los reflejos contracturantes y dolorosos a nivel de sinapsis de médula espinal sin afectar al músculo ni a la placa motora[1].
Luego de analizadas las evidencias fotográficas, se pudo verificar que:
-
1 y 2. Señalan que es un producto natural, un extracto de Bilberry (arándano).
-
3. Indican que “Contienen nutrientes estudiados y que muestran protegen la salud de los ojos”.
-
4. La composición descrita es la de un suplemento nutricional.
-
5. Las indicaciones se corresponden con un suplemento nutricional, con forma farmacéutica de cápsulas blandas.
La Organización Mundial de la Salud (OMS) define como PRODUCTO MÉDICO FALSIFICADO aquel que tergiversa de forma deliberada/fraudulenta su identidad, composición o fuente[2].
Teniendo en cuenta el análisis de la evidencia fotográfica y la definición de la OMS, se concluye que el producto MEHTOCARBAMOL 750 mg, es un MEDICAMENTO FALSIFICADO, por lo cual no se puede garantizar su calidad, seguridad y eficacia; constituye un riesgo inaceptable para la salud de la población; por lo que NO SE RECOMIENDA SU USO.
EL CECMED SOLICITA QUE ANTE LA DETECCIÓN DE ESTE PRODUCTO U OTROS SOSPECHOSOS DE FALSIFICACION, O LA APARICIÓN DE EVENTOS ADVERSOS RELACIONADOS A ESTOS SE NOTIFIQUE AL CORREO: vigilancia@cecmed.cu o a los teléfonos 72164372, 72164352, 72164136.
La Habana, Cuba. 8 de julio de 2024
Tags
COMUNICACIÓN DE RIESGO No. 14/2024. OZEMPIC® (semaglutida) FALSIFICADO DETECTADO EN LAS REGIONES DE LAS AMÉRICAS Y DE EUROPA DE LA OMS.
La Organización Mundial de la Salud (OMS) ha emitido su Alerta no. 2/2024 sobre Productos Médicos referida a tres lotes falsificados de OZEMPIC® (semaglutida) detectados en el Brasil (en octubre de 2023), el Reino Unido de Gran Bretaña e Irlanda del Norte (en octubre de 2023) y los Estados Unidos de América (en diciembre de 2023) que se suministraron a través de la cadena de suministro regulada.
OZEMPIC® (semaglutida) pertenece al grupo de medicamentos denominados «inhibidores del péptido similar al glucagón de tipo 1», que se indican para tratar la hiperglucemia de los adultos, los adolescentes y los niños mayores de 12 años con diabetes de tipo 2. La empresa Novo Nordisk, que fabrica el medicamento OZEMPIC® auténtico, ha confirmado que no ha fabricado los tres productos a los que se refiere la presente alerta y que son falsificados, ya que tergiversan su identidad y su fuente.
Concretamente, el fabricante ha señalado que:
-
no reconoce el número de lote LP6F832;
-
la combinación del número de lote NAR0074 y el número de serie 430834149057 no se corresponde con los registros de producción de la empresa;
-
el número de lote MP5E511 es auténtico, pero el producto es falsificado.
-
El uso de OZEMPIC® falsificado puede dar lugar al tratamiento ineficaz debido a la administración de dosis incorrectas, la contaminación por sustancias dañinas y el uso de componentes desconocidos o sustituidos. Además, puede generar otros riesgos graves para la salud debido a que se administra por vía intravenosa, que podría causar la muerte.
EL CECMED NO TIENE REGISTRADO EL PRODUCTO OZEMPIC®, SIN EMBARGO, TENIENDO EN CUENTA QUE VIAJEROS INTERNACIONALES PUEDEN ADQUIRIRLO, RECOMIENDA NO UTILIZAR LOS LOTES REFERIDOS DE ESTE PRODUCTO Y SOLICITA QUE ANTE LA DETECCIÓN DE ESTE PRODUCTO U OTROS SOSPECHOSOS DE FALSIFICACION, O LA APARICIÓN DE EVENTOS ADVERSOS RELACIONADOS A ESTOS SE NOTIFIQUE AL CORREO: vigilancia@cecmed.cu o a los teléfonos 72164372, 72164352, 72164136.
La Habana, Cuba. 4 de julio de 2024
Tags
KRYTANTEK OFTENO, solución oftálmica, FALSIFICADO
La Dirección General de Medicamentos, Insumos y Drogas (Digemid) del Ministerio de Salud, de Perú, ha realizado una alerta a los profesionales de la salud, instituciones, establecimientos farmacéuticos y no farmacéuticos del sector público y privado, y al público en general sobre la sobre la falsificación del producto KRYTANTEK OFTENO solución oftálmica caja con frasco gotero x 5mL, con el número de lote identificado 4026342
KRYTANTEK OFTENO es empleado para la disminución a largo plazo de la presión intraocular de pacientes con glaucoma de ángulo abierto o con hipertensión ocular.
La alerta se emite derivado del análisis y evaluación de la información remitida por la Dirección de Redes Integradas de Salud Lima Centro, en la Botica Oftálmicos. Este producto no cuenta con registro sanitario expedido por esa autoridad sanitaria, por lo que no se tiene evidencia de la calidad de los ingredientes ni del proceso de fabricación; además, de desconocer si cuenta con estudios que avalen su calidad, seguridad y eficacia. Por lo anterior no debe ser consumido por representar un riesgo a la salud.
El CECMED no tiene Registro Sanitario para este producto. No obstante, teniendo en cuenta que viajeros internacionales pueden adquirir el producto, el CECMED recomienda:
-
A la población no consumir este lote del producto KRYTANTEK OFTENO solución oftálmica
-
No adquirirlo si es de procedencia ilegitima ya que puede estar comprometida su calidad, seguridad y eficacia.
-
A los profesionales de la salud: en caso de identificar este producto o detectar sospechas de reacciones adversas asociada a su uso, notificar al correo: vigilancia@cecmed.cu o a los teléfonos 72164372, 72164352, 72164136.
Disponible en: https://www.digemid.minsa.gob.pe/webDigemid/alertas-modificaciones/2024/ alerta-digemid-no-60-2024 /
La Habana, 24 de junio de 2024
Tags
CYTOTEC (misoprostol) 200 mcg FALSIFICADO
La Dirección General de Medicamentos, Insumos y Drogas (Digemid) del Ministerio de Salud, ha realizado una alerta a los profesionales de la salud, instituciones, establecimientos farmacéuticos y no farmacéuticos del sector público y privado, y al público en general sobre la sobre la falsificación del producto CYTOTEC 200 mcg caja x 14 tabletas y CYTOTEC 200 mcg caja x 12 tabletas, con los números de lote identificados B30695, B30743 y B30321.
CYTOTEC (misoprostol) es empleado para el tratamiento de la úlcera duodenal y para la prevención de lesiones gastrointestinales inducidas por la administración de antinflamatorios no esteroideos en tratamientos de larga duración.
La alerta se emite derivado del análisis y evaluación de la información remitida por la intervención del operativo conjunto con el Ministerio Público y representantes de la Policía Nacional del Perú con la Dirección Regional de Salud de Ica.Este producto no cuenta con registro sanitario expedido por esa autoridad sanitaria, por lo que no se tiene evidencia de la calidad de los ingredientes ni del proceso de fabricación; además se desconoce si cuenta con estudios que avalen su calidad, seguridad y eficacia. Por lo anterior, no debe ser consumido, por representar un riesgo a la salud.
El CECMED no tiene Registro Sanitario para este producto. No obstante, teniendo en cuenta que viajeros internacionales pueden adquirir el producto, el CECMED recomienda:
-
A la población no consumir los lotes referidos del producto CYTOTEC 200 mcg caja x 14 tabletas y CYTOTEC 200 mcg .
-
No adquirirlo si es de procedencia ilegitima ya que puede estar comprometida su calidad, seguridad y eficacia.
-
A los profesionales de la salud: en caso de identificar este producto o detectar sospechas de reacciones adversas asociada a su uso, notificar al correo: vigilancia@cecmed.cu o a los teléfonos 72164372, 72164352, 72164136.
Disponible en: https://www.digemid.minsa.gob.pe/webDigemid/alertas-modificaciones/2024/ alerta-digemid-no-61-2024 /
La Habana, 24 de junio de 2024
