COMUNICACIÓN DE RIESGO No. 07/2022: ACTUALIZACIÓN DE LA INFORMACIÓN DE SEGURIDAD DE NIMESULIDA
La nimesulida es un fármaco antiinflamatorio no esteroideo (AINE) utilizado para el tratamiento del dolor leve a moderado y como antipirético. Está contraindicada en pacientes con hipersensibilidad a la nimesulida, al ácido acetilsalicílico u otros AINEs; no se debe administrar en pacientes con hemorragia gastrointestinal activa o úlcera gastroduodenal en fase activa, citopenias, insuficiencia cardiaca, renal o hepática e hipertensión arterial severa; no se debe administrar en niños menores de 12 años; ni durante la lactancia; ni el tercer semestre de embarazo.
En los últimos años se han reportado trastornos hepáticos graves asociados a su uso que llevaron a la suspensión de su comercialización en distintos países. Los efectos indeseables conocidos de la nimesulida son dispepsia, pirosis, náuseas, vómitos, diarrea y dolor en epigastrio de leve intensidad, erupción cutánea de tipo alérgico, prurito, eritema y edema facial, necrosis epidérmica y casos muy aislados de síndrome de Stevens-Johnson. Existen reportes de casos aislados compatibles con el síndrome de Reye. Además, vértigo, somnolencia, hiperexcitabilidad, otros desórdenes del sueño, sensibilidad y cefalea; úlceras pépticas, sangrado y perforación gastrointestinal; aumento de las enzimas hepáticas, hipertensión arterial.
La lesión hepática por nimesulida se produce por un mecanismo idiosincrásico metabólico, el cual es independiente de la dosis administrada y dependiente del paciente. La existencia de vías metabólicas aberrantes (prevalencia de la variante metabólica) permite la formación de metabolitos causantes de hepatotoxicidad (4-hidroxi-nimesulida), que se acumulan. Esta teoría queda avalada por un largo período de latencia hasta la aparición de los síntomas en ausencia de manifestaciones alérgicas.
Otro posible mecanismo sería la conversión de antígenos hepáticos en neoantígenos que provocarían una reacción inmunoalérgica por mecanismo inmunológico. Esta teoría queda avalada por la presencia de eosinofilia periférica asociada a eosinofilia tisular.2 Se señala que el tiempo de latencia para la hepatotoxicidad es impredecible ya que se han descrito casos de hepatitis fatal ocurrida después de 8 meses de tratamiento y otros después de tan solo 5 días. El daño hepático ocurre en los primeros 15 días en el 31% de los casos, entre 16 y 29 días en el 14% y luego de 30 días en el 37% de los reportes. En el 18 % de los casos no se describe relación de temporalidad.2
La hepatotoxicidad inducida por medicamentos es un problema de Salud Pública, el daño hepático inducido por medicamentos representa alrededor del 10 % de los casos de fallo hepático agudo a nivel mundial. Los fármacos han alcanzado el primer puesto como causa de fallo hepático fulminante tanto en Estados Unidos como en Europa. Con respecto a la aprobación de su comercialización, nimesulida nunca fue aprobada en Estados Unidos de América, Reino Unido, Canadá, Australia y Nueva Zelanda, debido a la preocupación por su perfil de seguridad.
Entre las agencias europeas de referencia que sí aprobaron su comercialización se encuentran España y Francia, pero ambas posteriormente suspendieron la misma. La medida regulatoria de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) fue una suspensión cautelar de la comercialización en 2002, porque su uso se asoció a un mayor riesgo, según frecuencia y gravedad, de inducir lesiones hepáticas en comparación con otros AINE. Se hizo hincapié en que estas reacciones fueron de tipo idiosincrásico, no ligadas a la dosis, y por tanto difícilmente predecibles.
En 2011, el Comité Francés de fármaco-economía dio de baja a medicamentos que contenían en su formulación nimesulida de la lista de medicamentos aprobados para reembolso y uso institucional, con la intención de reducir el número de prescripciones. Esto generó que las compañías farmacéuticas suspendieran su venta en Francia a finales del 2013.
Estudios observacionales documentan mayor riesgo de hepatotoxicidad de nimesulida con respecto a otros AINEs. Traversa y colaboradores (2003) realizaron un estudio de caso-control anidado en una cohorte, con el objetivo de comparar la incidencia de hepatotoxicidad aguda de nimesulida en relación a otros AINE. La cohorte incluyó 3 127 hepatopatías, de las cuales 819 usaron AINE y 176 casos de hepatopatías se atribuyeron al consumo de AINE. De los 176 casos, 47 correspondieron a hepatotoxicidad por este fármaco. En comparación con los otros AINE, en todas la hepatopatías la nimesulida presentó mayor tasa de riesgo ajustada por sexo y edad, OR 1.3 (IC 95% 0.7-2.3). 8 El resultado del estudio demostró que el riesgo de daño hepático grave fue casi dos veces mayor en pacientes tratados con nimesulida que en aquellos que utilizaban otros AINES: El Riesgo Relativo estimado ajustado por edad y sexo fue de 1.9 (IC 95% 1,1-3,8).
Donati y colaboradores realizaron un estudio multicéntrico de casos y controles entre 2010 y 2014, cuyo objetivo fue estimar el riesgo de lesión hepática aguda con nimesulida y otros AINE en relación a controles. El riesgo de presentar una lesión hepática aguda fue mayor en el grupo de AINE que el grupo control (OR ajustada 1.69 IC 95% 1.21-2.37). Los pacientes que usaron nimesulida fueron 30 casos y 184 controles. El riesgo para nimesulida presentó un OR ajustado de 2.1 (IC 95%, 1.28-3.47) en relación a otros AINE, siendo este resultado estadísticamente significativo.
En Francia, la Revue Prescrire publicó una revaluación del perfil de seguridad de nimesulida con base a los reportes de efectos adversos hepáticos brindados por el Comité de Medicamentos de Uso Humano (CHMP, por sus siglas en inglés), además de una exhaustiva revisión de la literatura y bases de datos europeas de farmacovigilancia. El análisis de los reportes de los 574 casos del CHMP mostró que las lesiones hepáticas (colestasis, ictericia, insuficiencia hepática, hepatitis e incluso la muerte por falla hepática) fueron superiores que para los COX 2.
La Agencia Europea de Medicamentos (EMA), luego de evaluar la seguridad hepática de nimesulida en 2007 a través del CHMP, determinó que la relación beneficio/riesgo continuaba siendo favorable, y mantuvo la comercialización de nimesulida, a pesar del retiro de circulación establecido por España y Finlandia. Se recomendó que su uso fuera restringido a no más de 15 días, que se removieran las presentaciones conteniendo más de 30 dosis, y se añadió como contraindicación en su prospecto a los pacientes con problemas hepáticos.
Sin embargo, la asociación internacional de boletines de medicamentos (ISBD por sus siglas en inglés) estableció que la conclusión de la EMA fue imprecisa y limitada, pues admitió que la hepatotoxicidad asociada a nimesulida fue superior comparado con el resto de los AINE, y asumió que con las limitaciones citadas se podía utilizar sin preocupación por el riesgo. La ISDB consideró estas medidas ineficaces y juzgó inaceptable comercializar un fármaco con una relación beneficio/riesgo no favorable.
En 2012 la EMA divulgó la conclusión de su revisión sobre la seguridad de nimesulida y determinó que, en comparación a otros AINE, se asoció a mayor riesgo de toxicidad hepática. Sin embargo, la relación beneficio/riesgo se ha mantenido positiva para esta agencia, y se mantuvo el uso para el dolor agudo y la dismenorrea, no así para osteoartritis.
En otras agencias europeas como Finlandia se suspendió la comercialización de nimesulida, mientras que en Portugal e Italia su comercialización está limitada a no más de 7 o 15 días respectivamente, para el tratamiento del dolor agudo y en dismenorrea, con una dosis máxima diaria de 200mg, y siempre después de la valoración del médico en cada paciente concreto. , .
De la información obtenida a partir de las Agencias Reguladoras consideradas de referencia regional, entre las que se encuentran Cuba-CECMED, Argentina-ANMAT, Brasil-ANVISA, México-COFEPRIS y Colombia-INVIMA, en el 2017, se destaca que en Cuba nimesulida nunca fue registrada. En 2009, Argentina suspendió la comercialización de todas las especialidades médicas que contenían nimesulida, mientras que Brasil, México y Colombia, contraindicaron su uso en menores de 12 años y emitieron recomendaciones para su uso en la población adulta en los años 2005, 2012 y 2013, respectivamente. 2
Con respecto a la información recogida de otras agencias latinoamericanas, se reporta que en Perú, Paraguay y Panamá nimesulida se retiró definitivamente del mercado en 2007, 2011 y 2015, respectivamente. , , . En Uruguay en 1997 se cambió la condición de venta a “medicamento bajo prescripción médica” y en 2003 se retiró el registro de presentaciones de 400 mg. En Chile, en 2004, se retiraron los registros de las presentaciones pediátricas y aquellas formulaciones con potencia superior a 100 mg. En el 2017 el fármaco se retiró totalmente del mercado. En Venezuela, en 2005 y en Ecuador, en 2011 se retiraron las presentaciones para uso pediátrico. 2
En Latinoamérica se han presentado casos de problemas hepáticos asociados con nimesulida, algunos con resultados fatales. Los casos fueron obtenidos a partir de una revisión de la literatura, la Base de Datos VigiBase® y los reportes recibidos en los diferentes centros de farmacovigilancia de los países latinoamericanos. Se registraron un total de 75 casos de hepatotoxicidad inducida por nimesulida, entre 1997 y 2016. De estos, diez resultaron en muerte del paciente; uno por hepatitis fulminante, tres por insuficiencia hepática fulminante, uno por lesión hepática grave (necrosis hepática), dos por falla hepática severa, uno por insuficiencia hepática aguda grave y dos por insuficiencia hepática grave por necrosis extensa y colestasis.
En Cuba, este medicamento no ha sido aprobado en el Cuadro Básico nacional debido a su relación beneficio-riesgo desfavorable ni cuenta con registro sanitario. El Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos (CECMED), como autoridad reguladora nacional realiza el seguimiento de la relación beneficio – riesgo de los medicamentos para identificar aquellos con un perfil de seguridad desfavorable.
En el caso de nimesulida existe una evidencia sólida sobre el riesgo de hepatotoxicidad, se conoce la característica idiosincrática de esta reacción y la posible aparición de reacciones anafilácticas con este medicamento, lo cual las hace impredecibles y no prevenibles. A pesar de que la nimesulida no se encuentra dentro del Cuadro Básico Nacional ni está registrada en el país, es importante que los profesionales sanitarios estén enterados de las medidas de retiro del mercado mundial y regional de este medicamento, debido a su perfil beneficio riesgo desfavorable. Se alerta a los profesionales sanitarios sobre la posible ocurrencia de estos efectos adversos y la necesidad de su reporte en caso de su detección.
EL CECMED SOLICITA QUE ANTE LA DETECCIÓN DE ESTE TIPO DE EVENTOS ADVERSOS SE NOTIFIQUE AL CORREO: vigilancia@cecmed.cu o puede hacerlo en el siguiente enlace https://ram.cecmed.cu/
LA FDA ADVIERTE SOBRE UN POSIBLE AUMENTO DEL RIESGO DE MUERTE Y EFECTOS SECUNDARIOS GRAVES CON EL MEDICAMENTO CONTRA EL CÁNCER COPIKTRA (DUVELISIB)
El día 30 de junio la Administración de Medicamentos y Alimentos (FDA, por sus siglas en inglés) ha publicado una comunicación de riesgo sobre el medicamento contra el cáncer Copiktra (duvelisib).
Copiktra fue aprobado en 2018 para tratar adultos con leucemia linfocítica crónica (LLC) o linfoma linfocítico pequeño (SLL) que recibieron al menos dos terapias anteriores que no funcionaron o dejó de funcionar. La CLL es un tipo de cáncer que comienza en los glóbulos blancos y la SLL es un tipo de cáncer que comienza principalmente en los ganglios linfáticos. Con la aprobación en 2018, la información sobre supervivencia o riesgo de muerte fue limitada y la FDA requirió un seguimiento más prolongado del ensayo clínico para obtener más información.
Para evaluar la seguridad a largo plazo de Copiktra, la FDA solicitó al fabricante del medicamento, Secura Bio, que presentara los resultados finales de supervivencia a 5 años del ensayo clínico denominado DUO, un ensayo abierto, aleatorizado y de fase 3. Se realizó en 319 pacientes con CLL o SLL que recibieron una terapia previa que no funcionó o dejó de funcionar. Estos resultados finales mostraron un posible aumento del riesgo de muerte con Copiktra en comparación con el anticuerpo monoclonal ofatumumab.
La tasa de efectos secundarios graves, modificaciones de dosis y muertes resultantes de estos efectos secundarios también fue mayor entre los pacientes que recibieron Copiktra. Los efectos secundarios graves incluyeron infecciones, diarrea, inflamación del intestino y los pulmones, reacciones cutáneas y niveles elevados de enzimas hepáticas en la sangre. Estos hallazgos de seguridad fueron similares para otros medicamentos en la misma clase de inhibidores de la cinasa PI3, que se discutieron en una reunión del comité asesor de expertos no pertenecientes a la FDA en abril de 2022.
Tags
COMUNICACIÓN DE RIESGO No. 04/2022: ACTUALIZACIÓN DE LA INFORMACIÓN DE SEGURIDAD DE MONTELUKAST
El Montelukast es un inhibidor de los leucotrienos, indicado para el tratamiento del asma persistente de leve a moderada, pacientes no controlados adecuadamente con corticosteroides inhalados y en quienes los beta‑agonistas de acción corta “a demanda” no permiten un control clínico adecuado de la enfermedad. En aquellos pacientes asmáticos en los que Montelukast está indicado para el asma, también puede proporcionar alivio sintomático de la rinitis alérgica estacional. También está indicado en la profilaxis del asma cuando el componente principal sea la broncoconstricción inducida por el ejercicio. En Cuba, este producto está aprobado para la profilaxis del asma bronquial en adultos y pacientes pediátricos de 12 meses de edad y mayores.
Sus efectos adversos conocidos y frecuentes son: dolor abdominal, dolor de cabeza, y sed. Con menor frecuencia se reportan reacciones alérgicas que incluyen erupción, hinchazón de la cara, labios, lengua, y/o garganta que puede causar dificultad respiratoria o para tragar, picor y urticaria. Además, cansancio, inquietud, excitación incluyendo comportamiento agresivo, irritabilidad, mareo, somnolencia, alucinaciones, alteraciones del sueño (pesadillas y problemas de sueño), hormigueo/adormecimiento, convulsiones; malestar, dolor articular o muscular, calambres musculares, boca seca, náuseas, vómitos, indigestión, diarrea, hepatitis; mayor posibilidad de hemorragia, hematoma, palpitaciones; e hinchazón.
Comunicación de Riesgo No. 01/22: ACTUALIZACIÓN DE LA INFORMACIÓN DE SEGURIDAD DE TRAMADOL
El tramadol es un opioide débil, con un consumo elevado desde el momento de su puesta en el mercado. La aparición de combinaciones de tramadol con paracetamol y dexketoprofeno, supuestamente a dosis bajas, ha hecho que se tenga una falsa sensación de seguridad y no haya conciencia de los riesgos del consumo crónico de este medicamento. En los últimos años han aparecido problemas relacionados con la seguridad, mal uso y comercio ilícito que de este fármaco se está haciendo a nivel mundial.[1]
Este medicamento produce los efectos adversos comunes de los opiáceos: digestivos (náuseas, vómitos, sequedad de boca y estreñimiento), neuropsiquiátricos (cefalea, somnolencia, vértigo, confusión, trastorno del humor, síndrome de abstinencia y dependencia física y psicológica), urinarios, depresión respiratoria y síndrome de abstinencia en los neonatos expuestos intraútero. También puede producir convulsiones y por tanto se deben evitar en caso de epilepsia o de toma concomitante de otros fármacos que las favorezcan (antidepresivos tricíclicos, Inhibidores selectivos de la recaptación de serotonina (ISRS) e Inhibidores selectivos de la recaptación de noradrenalina (ISRNA), antipsicóticos, bupropión y opiáceos), hipo, toxicidad hepática (sobre todo en combinación con paracetamol), hipotensión y rigidez muscular.
Aparte de los efectos adversos de grupo, en los últimos años a nivel internacional se han descrito problemas de seguridad específicos de tramadol como: hiponatremia, hipoglucemia y síndrome serotoninérgico.
• Síndrome serotoninérgico y convulsiones.[2] Es uno de los efectos adversos más graves del tramadol. La frecuencia de aparición es baja, aunque puede verse aumentada en pacientes con comorbilidades, uso de dosis supraterapéuticas y el consumo simultáneo de antidepresivos (ISRS, ISRNA, mirtazapina, tricíclicos e inhibidores de la monoaminooxidasa (MAO)), linezolid, antiparkinsonianos inhibidores de la MAO B, bupropión, litio, triptanes y drogas de abuso (cocaína, MDMA (Éxtasis; 3,4-metilendioximetanfetamina), LSD (dietilamida de ácido lisérgico)). Las convulsiones asociadas a tramadol son más comunes en pacientes con epilepsia, ictus, enfermedad renal, traumatismo craneal y especialmente en pacientes con historial de abuso y sobredosis de este medicamento.
• Hipoglucemia. Desde el 2013 se encuentra incluido en la ficha técnica de tramadol el riesgo de hipoglucemia. Esta podría tener relación con su mecanismo de acción. Este medicamento inhibe la gluconeogénesis hepática y potencia la utilización periférica de la glucosa no mediada por insulina. La estimulación de los receptores μ con este fármaco en la corteza cerebral y en el hipotálamo incrementaría la señalización de la insulina y aumentaría la sensibilidad hepática a la insulina.[3],[4]
• Hiponatremia. Se han descrito casos de hiponatremia en pacientes tratados con tramadol, sobre todo al inicio del tratamiento, atribuida a un síndrome de secreción inadecuada de la hormona antidiurética (SIADH). Se ha planteado la hipótesis de que el riesgo de hiponatremia aumenta por activación de los receptores µ o por inhibición de la recaptación de serotonina-noradrenalina. La codeína también está asociada con la aparición de hiponatremia.[5],[6],[7]
• Hiperacusia. En 2020, el centro de farmacovigilancia de la Organización Mundial de la Salud (OMS), notificó 20 casos de hiperacusia asociada al consumo de tramadol. Los pacientes tenían entre 17 y 62 años y el 75 % eran mujeres. El tiempo de aparición de los síntomas fue de 15 minutos a unas pocas horas desde la toma del fármaco. La oxicodona es otro opioide asociado con la aparición de hiperacusia.[8]
• Uso conjunto con gabapentinoides. Tramadol a dosis terapéuticas no presenta riesgo de depresión respiratoria, pero a dosis supraterapéuticas y en casos de sobredosis este riesgo puede aumentar. Gabapentina y pregabalina se utilizan ampliamente para tratar el dolor crónico y su uso puede potenciar el efecto sedante y depresor del Sistema Nervioso Central (SNC) producido por los opioides. En estos estudios[9],[10],[11] se concluye que estos dos fármacos producen un aumento de riesgo de muerte en pacientes que toman opioides a cualquier dosis, aunque este riesgo es más alto a dosis elevadas. Estos datos serían mucho más preocupantes si se añaden los casos de toma de gabapentinoides y opioides de forma recreativa.
• Mortalidad: En pacientes mayores de 50 años con artrosis, la prescripción inicial de tramadol está asociada con una mayor mortalidad después de un año de seguimiento comparado con la prescripción de antiinflamatorios no esteroideos (AINEs). En los últimos años en Estados Unidos el tramadol siempre aparece entre los 10 fármacos más comúnmente implicados en muertes (suicidios) por sobredosificación.[12],[13]
• Dependencia y uso ilícito:[14],[15].[16] Además de los síntomas típicos de abstinencia de opioides, la abstinencia a tramadol puede incluir alucinaciones, paranoia, ansiedad, confusión y experiencias sensoriales desagradables. En Francia (Agencia Vigilancia de Adicciones) se ha detectado un consumo extendido de tramadol-paracetamol que no busca un efecto psicoactivo contra el dolor, sino que busca una acción estimulante, euforizante, ansiolítica o sedativa.
Tras la prohibición de los jarabes con codeína, el uso de tramadol ha aumentado en zonas en guerra de África y el sudeste asiático. En zonas de África su uso se ha descontrolado debido a la utilización para disminuir la fatiga y las intensas jornadas laborales. Esta pandemia de tramadol es similar a la ocurrida con la oxicodona en Estados Unidos.
Debido al elevado uso y abuso de este medicamento, en el 2007 se incluyó en la lista IV de sustancias controladas en Estados Unidos. En un estudio realizado en dos de sus estados, se constató que dos años después de la inclusión en esta lista, los casos de sobredosis disminuyeron de manera considerable. Desde 2013 también se encuentra incluido en el listado de medicamentos de clase C y la lista III de la Regulación de Mal Uso de Medicamentos del 2001 en el Reino Unido.
• Recientemente se han añadido a la ficha técnica de tramadol la apnea del sueño y la insuficiencia adrenal como efectos adversos a tener en cuenta.[17]
- Trastornos respiratorios relacionados con el sueño, incluidas apnea central del sueño (ACS) e hipoxemia relacionada con el sueño, siendo este efecto dependiente de la dosis. Se debe reducir la dosis total en pacientes que presenten ACS.
- Insuficiencia suprarrenal reversible, que requiere monitorización y tratamiento de reposición con glucocorticoides. Los síntomas que pueden aparecer son: dolor abdominal grave, náuseas y vómitos, presión arterial baja, fatiga extrema, disminución del apetito y pérdida de peso.
En Cuba, en los últimos 5 años, se han recibido en la base de datos nacional de farmacovigilancia un total de 577 reportes de reacciones adversas a tramadol, para un 0,9 %. Según grupo de edad y sexo, las reacciones adversas predominaron en los adultos entre 19 y 59 años (365 notificaciones, 63,2 %) y en las mujeres (369 notificaciones, 63,9 %). El medicamento fue indicado mayormente para dolor por cólico nefrítico, cefalea y migraña, dolores articulares y ciatalgia, así como dolor por neoplasias malignas.
Predominaron los siguientes sistemas de órganos: digestivo (192 reportes, 33,2 %) seguido del sistema nervioso central (143 reportes, 24,8 %), sistema cardiovascular (97 reportes, 16,8 %), la piel (52 reportes, 9,0 %) y los síntomas generales (41 reportes, 7,1 %). Los tipos de reacciones adversas más notificados fueron vómitos, mareos, náuseas, cefalea y taquicardia. Según intensidad e imputabilidad se reportaron en su mayoría reacciones moderadas (449 reportes, 77,8 %) y probables (397 reportes, 68,8 %). Según frecuencia, aquellas consideradas de baja frecuencia (ocasional, rara y no descrita) con 462 reportes (80,1 %), predominaron sobre las frecuentes.
El Sistema Cubano de Farmacovigilancia solo ha detectado, entre el 2017 y el 2021, cuatro casos de convulsiones, otros trastornos del sueño (somnolencia) así como síncope y estado confusional. Por estas razones debe mantenerse el seguimiento y la vigilancia de estos riesgos. Además, teniendo en cuenta que este medicamento está sujeto a prescripción controlada, se alerta a los profesionales sanitarios sobre la posible ocurrencia de estas reacciones adversas.
EL CECMED SOLICITA QUE ANTE LA DETECCIÓN DE ESTE TIPO DE EVENTOS ADVERSOS SE NOTIFIQUE AL CORREO: vigilancia@cecmed.cu
La Habana, Cuba. 6 de junio de 2022
[1] Francisco Tejada Cifuentes, Gregorio Romero Candel. Tramadol: actualización en eficacia y seguridad. SESCAM: Servicio de Salud Castilla-La Mancha. Hoja de Evaluación de Medicamentos Castilla-La Mancha. Año 2022. Vol. XXIII, N. º 1.
[2] Hassamal S, Miotto K, Dale W, Danovitch I. Tramadol: Understanding the Risk of Serotonin Syndrome and Seizures. The American Journal of Medicine. Volume 131, Issue 11, November 2018, Pages 1382.e1-1382.e6. https://doi.org/10.1016/j.amjmed.2018.04.025.
[3] Fournier JP, Azoulay L, Yin H, Montastruc JL, Suissa S. Tramadol Use and the Risk of Hospitalization for Hypoglycemia in Patients With Noncancer Pain. JAMA Intern Med . 2015 Feb;175(2):186-93. doi: 10.1001/jamainternmed.2014.6512.
[4] Juba KM, van Manen RP, Fellows SE. A Review of the Food and Drug Administration Adverse Event Reporting System for Tramadol-Related Hypoglycemia. Ann Pharmacother. 2020 Mar;54(3):247-253. doi: 10.1177/1060028019885643
[5] Falhammar H, Calissendor J, Skov J, Nathanson D, Lindh JD, Mannheimer B. Tramadol and codeine-induced severe hyponatremia: A Swedish population-based case-control study. European Journal of Internal Medicine 69 (2019) 20–24. https://doi.org/10.1016/j.ejim.2019.08.006.
[6] Fournier JP, Yin H, Nessim SJ, Montastruc JL, Azoulay L. Tramadol for Noncancer Pain and the Risk .of Hyponatremia. The American Journal of Medicine (2015) 128, 418-425. http://dx.doi.org/10.1016/j.amjmed.2014.10.046.
[7] Canecaude C, Rousseau V, Chebane L, Lafaurie M, Durrieu G, Montastruc JL. Can tramadol really induce hyponatraemia? A pharmacovigilance study. Br J Clin Pharmacol. 2021;87:683–686. DOI: 10.1111/bcp.14401.
[8] Tramadol: hyperacousies. Rev Prescrire 2021 ; 41 (453) : 513.
[9]Gomes T, Juurlink DN, Antoniou T, Mamdani MM, Paterson JM, van den Brink W. Gabapentin, opioids, and the risk of opioid related death: A population-based nested case-control study. PLOS Medicine | https://doi.org/10.1371/journal.pmed.1002396. October 3, 2017.
[10] Gomes T, Greaves S, van den Brink W, Antoniou T, Mamdani MM, Paterson JM et al. Pregabalin and the risk for opioid-related death: a nested case–control study.. Ann Intern Med. 2018 Nov 20;169(10):732-734.
[11] Abrahamsson T, Berge J, Öjehagen A, Håkansson A. Benzodiazepine, z-drug and pregabalin prescriptions and mortality among patients in opioid maintenance treatment-A nation-wide register-based open cohort study. Drug Alcohol Depend. 2017 May 1;174:58-64.
[12] Dart RC, Surratt HL, Cicero TJ, Parrino MW, Severtson SG, Bucher-Bartelson B et al. Trends in opioid analgesic abuse and mortality in the United States. N Engl J Med. 2015 Jan 15;372(3):241-8. doi: 10.1056/NEJMsa1406143. PMID: 25587948.
[13] Hedegaard H, Bastian BA, Trinidad JP, Spencer M, Warner M. Drugs Most Frequently Involved in Drug Overdose Deaths: United States, 2011-2016. Natl Vital Stat Rep. 2018 Dec;67(9):1-14.
[14] Spiller HA, Scaglione JM, Aleguas A, Foster H, Durback-Morris L, Scharman EJ, Baker SD. Effect of scheduling tramadol as a controlled substance on poison center exposures to tramadol. Ann Pharmacother. 2010 Jun;44(6):1016-21. doi: 10.1345/aph.1P064. Epub 2010 Apr 20. PMID: 20407028.
[15] Chen TC, Chen LC, Knaggs RD. A 15-year overview of increasing tramadol utilisation and associated mortality and the impact of tramadol classification in the United Kingdom. Pharmacoepidemiol Drug Saf. 2018 May;27(5):487-494. doi: 10.1002/pds.4320. Epub 2017 Sep 24. PMID: 28944519.
[16] Advisory Council on the Misuse of Drugs. Advisory council on the misuse of drugs consideration of tramadol. February 2013; https://www.gov.uk/government/uploads/system/uploads/attachment_data/fi… (acceso diciembre 2021).
[17] Ficha Técnica autorizada de Adolonta®. Disponible en:
https://cima.aemps.es/cima/pdfs/es/ft/61784/FT_61784.pdf [Consultada diciembre 2021].
AEMPS. 15º INFORME DE FARMACOVIGILANCIA SOBRE VACUNAS COVID-19
El día 25 de mayo la AEMPS ha publicado su informe de farmacovigilancia sobre las vacunas COVID-19, en la cual actualiza la información sobre Comirnaty y Spikevax, refiriendo que la evidencia es insuficiente para establecer su asociación con la aparición de hepatitis autoinmune.
Actualmente, hay cinco vacunas frente a la COVID-19 autorizadas en la Unión Europea (UE).
Información sobre las vacunas administradas actualmente
Comirnaty
- Conclusiones de la evaluación de los datos de farmacovigilancia desde el informe anterior
Desde que se autorizó su comercialización en la Unión Europea hasta el 24 de abril de 2022, se han administrado en el Espacio Económico Europeo (EEE) alrededor de 600 millones de dosis de Comirnaty en adultos y alrededor de 27 millones de dosis en niños y adolescentes menores de 18 años.
-
- Reacciones adversas identificadas
Desde el informe anterior no se han identificado nuevas reacciones adversas o nueva información sobre las reacciones adversas ya identificadas.
-
- Otros temas revisados
Hepatitis autoinmune
La hepatitis autoinmune es una enfermedad inflamatoria crónica y grave, en la que el sistema inmune ataca y daña el hígado. Sus signos y síntomas varían entre las personas y pueden incluir coloración amarilla de la piel (ictericia), acumulación de líquidos en las piernas (edema), o síntomas gastrointestinales (ascitis).
En base a la información procedente de la literatura científica, los casos de hepatitis autoinmune notificados a nivel mundial y los datos adicionales que han proporcionado los titulares de autorización de comercialización, el Comité de Evaluación de Riesgos de Farmacovigilancia (PRAC, por sus siglas en inglés) ha concluido que la evidencia disponible hasta el momento no apoya la existencia de una relación causal entre la administración de Comirnaty y Spikevax, y los casos de hepatitis autoinmune notificados.
No obstante, este riesgo continuará bajo estrecha vigilancia y se tomarán las medidas apropiadas en caso necesario.
- Acontecimientos adversos notificados en España hasta el 8 de mayo de 2022
Hasta el día 8 de mayo de 2022, se han administrado en España 65.862.638 dosis de Comirnaty, que corresponden a 28.764.023 personas. En este periodo se han registrado en la base de datos FEDRA un total de 38.624 notificaciones de acontecimientos adversos tras recibir Comirnaty; la mayoría corresponden a mujeres (74%) y a personas de entre 18 y 65 años (83%). De entre todas las notificaciones registradas, 7.325 fueron consideradas graves.
Las 38.624 notificaciones incluyen 94.737 términos descriptores de acontecimientos adversos. Los trastornos generales como fiebre o dolor en la zona de vacunación siguen siendo los acontecimientos notificados con mayor frecuencia, seguidos de los trastornos del sistema nervioso central (mayoritariamente cefaleas y mareos) y del sistema musculoesquelético (principalmente, mialgia y artralgia).
- Acontecimientos adversos notificados en niños
Hasta el 8 de mayo de 2022, de las 38.624 notificaciones registradas tras la administración de Comirnaty, 354 corresponden a esta población. Hasta esa misma fecha, se han administrado en España más de 3.1 millones de dosis en este grupo de población, por lo que la tasa de notificación se estima en 11 notificaciones registradas por 100.000 dosis administradas. De las 354 notificaciones de acontecimientos adversos, 108 fueron consideradas graves. Los 12 acontecimientos adversos más notificados fueron pirexia, linfadenopatía, cefalea, dolor en la zona de vacunación, vómitos, malestar, urticaria, diarrea, erupción, fatiga, dolor abdominal ymareos.
Spikevax (antes COVID-19 Vaccine Moderna)
- Conclusiones de la evaluación de los datos de farmacovigilancia desde el informe anterior
Desde que se autorizó su comercialización en la UE hasta el 24 de abril de 2022, se han administrado en el EEE alrededor de 153 millones de dosis de Spikevax en adultos y alrededor de 1,9 millones de dosis en niños y adolescentes menores de 18 años.
-
- Reacciones adversas identificadas
Desde el informe anterior no se han identificado nuevas reacciones adversas o nueva información sobre las reacciones adversas ya identificadas.
-
- Otros temas revisados
Hepatitis autoinmune
Ver apartado para la vacuna Comirnaty.
- Acontecimientos adversos notificados en España hasta el 8 de mayo de 2022
Hasta el día 8 de mayo de 2022, se administraron en España un total de 23.733.586 dosis de Spikevax, que corresponden a 5.337.609 personas. En este periodo se han registrado en FEDRA un total de 15.101 notificaciones de acontecimientos adversos tras la administración de la vacuna Spikevax; la mayoría son mujeres (72%) y personas de entre 18 y 65 años (90%). De todas las notificaciones de acontecimientos adversos recibidas, 2.182 fueron consideradas graves.
Las 15.101 notificaciones incluyen 40.522 términos descriptores de acontecimientos adversos. Los trastornos generales como fiebre o dolor en la zona de vacunación siguen siendo los notificados con más frecuencia, seguidos de los trastornos del sistema nervioso (mayoritariamente, cefaleas y mareos) y del sistema musculoesquelético (mialgia y artralgia).
Notificaciones recogidas tras la administración de terceras dosis
Hasta el día 8 de mayo de 2022, se administraron en España un total de 24.836.931 dosis de refuerzo, 45% de Comirnaty y 55% de Spikevax. En este periodo se han podido identificar en la base de datos FEDRA 2.020 notificaciones de acontecimientos adversos tras la administración de la tercera dosis, de ellas el 37% correspondían a la administración de Comirnaty y el 63% a Spikevax; la mayoría han ocurrido en mujeres (68%) y en personas de entre 18 y 65 años (87%). Es necesario tener en cuenta que la identificación de que el acontecimiento ocurrió tras la tercera dosis no siempre es posible en las notificaciones recibidas.
De todas las notificaciones de acontecimientos adversos identificadas, 608 fueron consideradas graves.
Los trastornos generales como fiebre o malestar son los notificados con más frecuencia, seguidos de los trastornos del sistema nervioso central (mayoritariamente, cefaleas y mareos) y del sistema musculoesquelético (mialgia y artralgia).
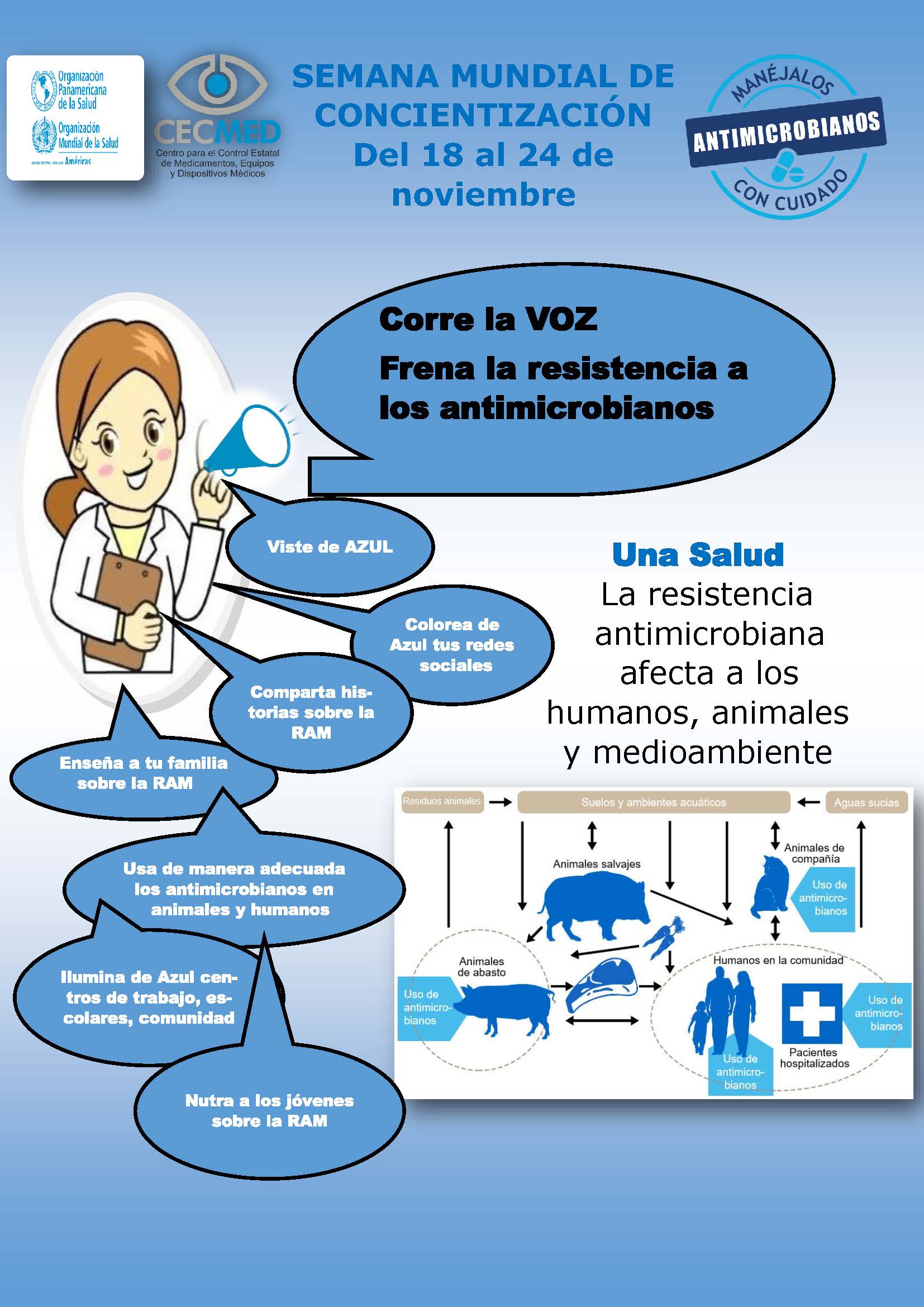
Una Salud. Semana Mundial de Concientización sobre el uso de los antimicrobianos
Una Salud. Semana Mundial de Concientización sobre el uso de los antimicrobianos
Tags

Semana Mundial de Concientización sobre el uso de los antimicrobianos 2021. Resistencia antimicrobiana
Semana Mundial de Concientización sobre el uso de los antimicrobianos 2021. Resistencia antimicrobiana
Tags

Semana Mundial de Concientización sobre el uso de los antimicrobianos 2021. COVID-19
Antimicrobianos y COVID-19. Semana Mundial de Concientización del usod e los antimicrobianos

"Ir de azul" en la Semana Mundial de Concientización sobre el uso de los antimicrobianos
Semana Mundial de Concientización sobre el uso de los antimicrobianos 2021
El CECMED se une a la Semana Mundial de Concientización sobre el uso de los antimicrobianos 2021
Tags